1、实验题 某学生模拟“李比希元素定量分析法”测定一种有机物X的组成,做了如下图所示的实验。他将0.3gX的蒸气由注射器A缓慢送入装有CuO的B装置,使之完全反应,得到如下结果

①实验前B管的总质量(含CuO)为21.32g,实验后为21.00g。
②C管中收集到的物质电解后得到H2和O2,在D中收集到的是一种无色无味的气体。
③X的蒸气在标况下的密度为1.34g/L,问:
(1)该有机物X的化学式为____________________;
(2)实验中B装置中看到的现象是_________________________________;写出B装置中发生的化学方程式________________________________
参考答案:(1)CH2O
(2)黑色固体变成红色;CH2O+2CuO 2Cu+CO2+H2O
2Cu+CO2+H2O
本题解析:
本题难度:一般
2、实验题 (16分)(一)某同学在一只烧杯里装入一定量的纯铁粉,加入200mL 6mol/L的硝酸,铁粉恰好溶解,请探究产物中铁元素价态:
(1)提出假设:
假设1:产物只有+2价铁;
假设2:___________________________________;
假设3:___________________________________。
(2)设计实验:取反应所得溶液分别装入甲、乙两支试管,在甲中滴加酸性KMnO4溶液;在乙中滴加KSCN溶液,观察现象,推测实验现象与结论:
①若现象为____________________,则假设1正确;
②若现象为____________________,则假设2正确;
③若现象为____________________,则假设3正确。
(二)、氯化铁是常见的水处理剂,工业上制备无水FeCl3的流程为:
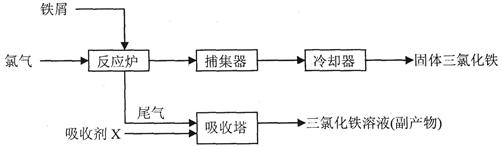
(3)吸收剂X为FeCl2溶液,其与尾气Cl2反应的离子方程式__________________。
(4)称取上述样品m克溶于25mL稀盐酸,用蒸馏水配成50mL溶液,加入稍过量的KI溶液充分反应: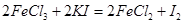 ,用淀粉作指示剂,用
,用淀粉作指示剂,用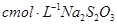 溶液进行滴定
溶液进行滴定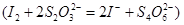 ,消耗Na2S2O3溶液VmL,则样品中FeCl3的质量分数为____。(相对原子质量Fe:56? Cl:35.5)
,消耗Na2S2O3溶液VmL,则样品中FeCl3的质量分数为____。(相对原子质量Fe:56? Cl:35.5)
(5)用FeCl3溶液(32%-35%)腐蚀铜板电路时所得废液含FeCl3、FeCl2和CuCl2,若用化学方法回收废液中的铜,简述操作要点:___________________________________________________。
参考答案:(1)假设2:产物中只有+3价铁元素(1分)
假设3:产物中既有+2价又有+3价铁元素。(1分)
(2)①甲试管溶液紫色褪去,乙试管没有明显变化;(2分)
②甲试管溶液无明显变化,乙试管溶液变红色;(2分)
③甲试管溶液颜色褪去,乙试管溶液变红色。(2分)
(3)Cl2+2Fe2+=2Cl-+2Fe3+(3分)?
(4)16.25 Vc/m%(3分)
(5)加过量Fe粉,将所得固体用过量盐酸溶解残留的铁粉,过滤、洗涤、干燥。(2分)
本题解析:(1)由于铁的价态是+2价或+3价,所以分别是假设2:产物中只有+3价铁元素;假设3:产物中既有+2价又有+3价铁元素。
(2)①由于亚铁离子具有还原性,所以如果假设I正确,则现象是甲试管溶液紫色褪去,乙试管没有明显变化。
②如果是假设Ⅱ正确,则铁离子能和KSCN溶液发生显色反应,因此现象是甲试管溶液无明显变化,乙试管溶液变红色。
③如果是假设Ⅲ正确,则现象就是甲试管溶液颜色褪去,乙试管溶液变红色。
(3)氯气具有氧化性,能氧化氯化亚铁,生成氯化铁,方程式为Cl2+2Fe2+=2Cl-+2Fe3+。
(4)根据方程式可知,FeCl3~Na2S2O3,所以氯化铁的物质的量是0.001cVmol,所以样品中FeCl3的质量分数为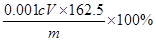 。
。
(5)要回收铜,则应该加入过量的铁粉,置换出铜,过量的铁用盐酸溶解即可。所以正确的操作是加过量Fe粉,将所得固体用过量盐酸溶解残留的铁粉,过滤、洗涤、干燥。
留的铁粉,过滤、洗涤、干燥。(2分)
本题难度:一般
3、选择题 有关物质的检验,以下说法正确的是( )
A.向某溶液中滴加AgNO3溶液,生成白色沉淀,说明原溶液中含有Cl-
B.某气体可以使燃着的木条熄灭,说明该气体是CO2
C.加入盐酸,放出能使澄清石灰水变浑浊的无色无味的气体,不一定是含有CO32-
D.向某溶液中滴加BaCl2溶液,有白色沉淀产生,说明原溶液中一定存在CO32-或者SO42-
参考答案:A、向某溶液中滴加AgNO3溶液,生成白色沉淀,说明原溶液中含有Cl-或是CO32-等离子,故A错误;
B、某气体可以使燃着的木条熄灭,说明该气体是CO或是CO2中的至少一种,故B错误;
C、加入盐酸,放出能使澄清石灰水变浑浊的无色无味的气体,则溶液中可以含有碳酸根离子、碳酸氢根离子、亚硫酸根离子或是亚硫酸氢根离子中的至少一种,故C正确;
D、向某溶液中滴加BaCl2溶液,有白色沉淀产生,说明原溶液中存在CO32-、SO42-、Ag+中的至少一种,故D错误.
故选C.
本题解析:
本题难度:一般
4、实验题 据统计,每年世界上银总消耗量的40%用于感光材料的生产,感光材料经曝光、显影、定影后,黑白片上的银80%左右进入定影液,彩色片上的银几乎全部进入废定影液,所以废定影液中银的含量是十分惊人的。
某研究性学习小组拟对某照相公司的废定影液进行实验处理,回收其中的银和溴。
(一) 资料支撑:
① 定影液(硫代硫酸钠,Na2S2O3)跟胶片或相纸上没有感光部分的溴化银反应,反应方程式为:AgBr(s)+? 2Na2S2O3(aq) = Na3[Ag(S2O3)2](aq) + NaBr(aq)。
② 在酸的作用下,Na3[Ag(S2O3)2]能转化为不溶性的Ag2S。反应原理为:
6HCl+2Na3[Ag(S2O3)2]=6NaCl+Ag2S↓+3S↓+3SO2↑+H2SO4+2H2O。
③溶液中有少量溴化银,可用锌将其还原出来。
(二) 实验程序设计

(三) 试回答下列问题
(1)本实验需用6mol/L的盐酸250mL,配制时除需量筒、烧杯、玻璃棒外,还需用的仪器有:?、?。
(2)指出流程图中操作所包含的装置是(填序号:A、B、C)Ⅰ?Ⅱ?Ⅲ?。

(3)步骤③是在空气中灼烧的。该反应的化学方程式:?。实验操作时,加入适量的硝酸钾加盖后再灼热,加硝酸钾的目的可能是:?。
(4)加入锌粉发生的离子反应为:?。
参考答案:(1)250mL容量瓶、胶头滴管 (2)C;B;A
(3)Ag2S + O2 2Ag + SO2;释放氧气,使硫化银完全被氧化;
2Ag + SO2;释放氧气,使硫化银完全被氧化;
(4)2AgBr + Zn =" Ag?" + Zn2+ + 2Br-.
本题解析:前两题主要考查了基本实验操作。一是物质的量浓度溶液的配制,需要用到容量瓶(注意要写规格)和胶头滴管。一是过滤、萃取分液、蒸馏三种基本的物质分离方法。
未知反应的方程式书写,由题示中分析出滤渣主要是Ag2S,而产物是Ag,由于在空气中发生,少不了氧气的参与。根据氧化还原规律,推知尚有另一种产物二氧化硫。方程式写出,自然可以判断出硝酸钾的用途是为了放出氧气以便氧化更加彻底。
本题难度:一般
5、实验题 某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如下图所示的装置。

请回答下列问题。
(1)铜和浓硫酸反应的化学方程式为____________________。
(2)B瓶中盛有品红溶液,观察到品红溶液褪色,这是因为SO2具有___________(填选项的字母,下同),C瓶中盛有新制的氯水,观察到氯水褪色,这是因为SO2具有___________。
A.氧化性 B.还原性 C.漂白性
(3)D瓶中盛有NaOH溶液,作用是___________,该反应的离子方程式为______________________。
(4)充分反应后,小组同学发现铜和硫酸都有剩余。若想使剩余的铜片溶解,可再加入__________(填选项的字母)。
A.HNO3 B.NaNO3 C.NaHCO3 D.Na2CO3
参考答案:(1)Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
(2)C;B
(3)吸收剩余的SO2,防止造成空气污染;SO2+2OH- =SO32-+H2O
(4)AB
本题解析:
本题难度:一般