1、填空题 某河道两旁有甲、乙两厂,它们排放的工业废水中含有K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子,甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、________、__________。乙厂的废水中含有另外三种离子,如果加一定量________(填“活性炭”“硫酸亚铁”或“铁粉”),可以回收其中的金属________(填元素符号)。另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的________转为沉淀,经过滤后的废水主要含_______,可用来浇灌农田。
参考答案:OH-;Cl-;K+;铁粉;Ag;Ag+、Fe3+、Cl-、OH-;KNO3
本题解析:
本题难度:一般
2、填空题 (1)有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时丙为负极;把乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是?。
(2)向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为_______________。
(3) 现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是_______________
①20 mL 0.01 mol·L-1KCl溶液
②30 mL 0.02 mol·L-1CaCl2溶液
③40 mL 0.03 mol·L-1HCl溶液
④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1 AgNO3溶液
(4)某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。此电池的负极发生的电极反应式是_______________?;
(5)某酸H2B在水溶液中有如下变化:H2B H++HB-;HB-
H++HB-;HB- H++B2-;现有溶液? 0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液? 0.10mol/L、100ml,试回答以下问题:
①溶液中的H+物质的量取值范围是:?
②已知0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是?0.11 mol·L-1(填“<”,“>”,或“=”)
参考答案:(1 ) 丙丁乙甲
(2)AgCl>AgI>Ag2S
(3)④>①>③>②>⑤
(4)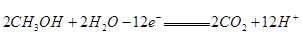
(5)(1)0.01<n(H+)<0.02?(2)? <
本题解析:(1)金属性强弱体现在与酸反应时的剧烈程度,组合成原电池时两极的现象,及金属间的置换反应;(2)向某难溶物的溶液中滴加其他溶液时可生成溶解度更小的物质;(3)由同离子效应可确定AgCl在不同溶液中的溶解度大小顺序为④>①>③>②>⑤;(4)甲醇燃料电池的负极物为甲醇,反应式为2CH3OH+2H2O-12e-=2CO2+12H+;(5)H2B在水溶液中电离方程式可知,H2B为强酸,HB-为弱酸,所以溶液H+的物质的量范围为0.01<n(H+)<0.02?;0.1mol·L-1NaHB溶液的pH=2,则0.1mol/L的HB-电离的H+为0.01mol/L,而0.1mol/L的H2B中,第一步电离出的0.1mol/L的H+会抑制第二步电离,导致氢离子浓度小于0.11mol/L。
本题难度:一般
3、选择题 在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
A.Fe3+、K+、Cl-、MnO4-
B.Ag+、Na+、NO3-、I-
C.Zn2+、Al3+、SO42-、Cl-
D.Ba2+、NH4+、Cl-、HCO3-
参考答案:A.酸性溶液中MnO4-、Cl-发生氧化还原反应,则不能共存,且Fe3+为黄色,MnO4-为紫色,故A不选;
B.因Ag+、I-能结合生成沉淀,则不能共存,故B不选;
C.因该组离子之间不反应,则能共存,且离子均为无色,故C选;
D.强酸性溶液中含有大量的H+,与HCO3-结合生成水、气体,则不能共存,故D不选;
故选C.
本题解析:
本题难度:简单
4、选择题 某同学对一无色透明溶液进行分析,得出该溶液中含有下列某组离子,你认为该组离子应是( )
A.Al3+、NO3ˉ、K+、SO42ˉ
B.Ca2+、H+、HCO3ˉ、Na+
C.OHˉ、CO32-、Ca2+、SO42ˉ
D.Fe3+、Mg2+、NO3ˉ、Clˉ
参考答案:A、该组离子之间不反应,且均为无色,故A正确;
B、因H+、HCO3ˉ能结合生成水和二氧化碳,该组离子不能共存,故B错误;
C、因CO32-、Ca2+能结合生成沉淀,SO42-、Ca2+能结合生成沉淀,不能共存,故C错误;
D、该组离子之间不反应,但Fe3+在水中为黄色,与无色溶液不符,故D错误;
故选A.
本题解析:
本题难度:一般
5、选择题 常温下测得某无色溶液中由水电离出的H+浓度为1×10—13mol/L,又知该溶液中还有NO3-,Na+,Cl-,那么该溶液中还一定能存在的离子是( )
A.AlO2—、ClO—
B.Mg2+、、SO42—
C.Fe2+、Cu2+
D.Ba2+、K+