1、选择题 在相同温度和压强下,对反应CO2(g)+H2(g)  CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:

上述四种情况达到平衡后,n(CO)的大小顺序是( )
A.乙=丁>丙=甲
B.乙>丁>甲>丙
C.丁>乙>丙=甲
D.丁>丙>乙>甲
参考答案:A
本题解析:根据反应方程式:
CO2(g)+H2(g)  CO(g)+H2O(g)
CO(g)+H2O(g)
甲:? a mol?a mol?0 mol?0 mol
乙:? 2 a mol? a mol?0 mol?0 mol
丙:? 0 mol?0 mol ?a mol?a mol
丁:? a mol?0 mol?a mol?a mol
根据极端假设的思想,将产物全部转化为反应物,发现甲和丙中加入的物质的量一样,乙和丁中加入的物质的量一样,因此甲和丙、乙和丁属于等效平衡,达到平衡后CO的物质的量:甲=丙、乙=丁,乙和甲相比,乙相当于在甲的基础上多加了a mol CO2,增大反应物的浓度,平衡右移,因此达到平衡后CO的物质的量乙>甲,故n(CO)的大小顺序为:乙=丁>丙=甲。
本题难度:一般
2、选择题 将等物质的量的A、B混合于2L的密闭容器中,发生反应3A(g)+B(g)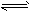 xC(g)+2D(g),经
xC(g)+2D(g),经
4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率
v(C)=0.125mol·L-1·min-1,下列说法正确的是
[? ]
A.v(B)=0.13mol·L-1·min-1
B.4min时,A的物质的量为0.75mol
C.该反应方程式中,x=1
D.4min时,A的转化率为50%
参考答案:D
本题解析:
本题难度:一般
3、填空题 已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃
| 700
| 800
| 830
| 1000
| 1200
|
平衡常数
| 1.7
| 1.1
| 1.0
| 0.6
| 0.4
|
回答下列问题:
(1)该反应的平衡常数表达式K=??,△H ?0(填“>”“<”或“=”);
(2)830℃时,向一个5L密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1,则6s时c(A)=? mol·L-1,C的物质的量为??mol;若反应经一段时间后,达到平衡时A的转化率为
??,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ??;
(3)判断该反应是否达到平衡的依据为?(填正确选项前的字母);
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为 ??
A(g)+B(g)的平衡常数的值为 ??
参考答案:(1)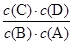 ?<
?<
(2)0.022; 0.09; 80%;80%(3)c(4)2.5
本题解析:(1)可逆反应A(g)+B(g)?C(g)+D(g)的平衡常数表达式k=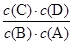 由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0,
由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0,
(2)反应初始6s内A的平均反应速率v(A)=0.003mol?L-1?s-1,则6s内△c(A)=0.003mol?L-1?s-1×6s=0.018mol/L,A的起始浓度为0.2mol/5L=0.04mol/L,故6s时时c(A)=0.04mol/L-0.018mol/L=0.022mol/L,
故6s内△n(A)=0.018mol/L×5L=0.09mol,由方程式可知n(C)=△n(A)=0.09mol,
设平衡时A的浓度变化量为x,则:
A(g)+B(g)?C(g)+D(g)
开始(mol/L):0.04?0.16?0?0
变化(mol/L):x?x? x?x
平衡(mol/L):0.04-x? 0.16-x?x?x
故x2/(0.04-x)( 0.16-x)=1,解得x=0.032
所以平衡时A的转化率为0.032/0.04×100%=80%
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变为80%,
(3)a.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,故a错误,?b.混合气体的总质量不变,容器的容积不变,故混合气体的密度始终不变,故气体的密度不随时间改变,不能说明到达平衡,故b错误,c.可逆反应到达平衡时,各组分的浓度不发生变化,故c(A)不随时间改变,说明到达平衡,故c正确,d.单位时间里生成C和D的物质的量相等,都表示正反应速率,反应始终按1:1生成C、D的物质的量,不能说明到达平衡,故d错误,故答案为:c;
(4)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数,故1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为1/0.4=2.5,
本题难度:一般
4、选择题 将a L SO3气体通过灼热的装有催化剂(V2O5)的硬质玻璃管,2SO3(g)  2SO2(g)+O2(g),达平衡后测得气体体积增大了b L(气体体积均在同温同压下测定),则下列叙述正确的是
2SO2(g)+O2(g),达平衡后测得气体体积增大了b L(气体体积均在同温同压下测定),则下列叙述正确的是
[? ]
A.SO3的转化率为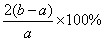
B.平衡混合气体的平均相对分子质量为
C.混合气体中SO2的体积分数为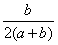
D.反应前与反应后气体的密度之比为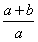
参考答案:D
本题解析:
本题难度:一般
5、选择题 温度体积固定的容器中建立2NO2 N2O4平衡,平衡时NO2与N2O4物质的量浓度之比为Φ,条件不变的情
N2O4平衡,平衡时NO2与N2O4物质的量浓度之比为Φ,条件不变的情 况下,分别再充入NO2和再充入N2O4,平衡后会引起Φ的变化正确的是:
况下,分别再充入NO2和再充入N2O4,平衡后会引起Φ的变化正确的是:
A.都引起Φ增大
B.充入NO2引起Φ增大,充入N2O4引起Φ减小
C.都引起Φ减小
D.充入NO2引起Φ减小,充入N2O4引起Φ增大
参考答案:C
本题解析:略
本题难度:一般