1、选择题 用18mol/LH2SO4溶液和100mL容量瓶配制1.8mol/LH2SO4溶液,下列有关说法正确的是( )
A.将10mLl8mol/LH2SO4溶液加入盛有90mL水的容量瓶中
B.将10mLl8mol/LH2SO4溶液加入容量瓶中,加水至刻度线
C.加水时不慎超过刻度线,倒出一些液体重新加水至刻度线
D.此实验中玻璃棒有搅拌和引流的作用
参考答案:A.溶液的体积不为100ml,容量瓶不能直接配制溶液,故A错误;
B.容量瓶不能直接配制溶液,且应为浓硫酸倒入水中,故B错误;
C.加水时不慎超过刻度线,溶液的体积增大,浓度减小,应重新配制,故C错误;
D.稀释时玻璃棒起搅拌作用,转移液体时起引流作用,故D正确.
故选D.
本题解析:
本题难度:简单
2、选择题 体积相同的某营养液两份,其配方如下:
| KCl | K2SO4 | ZnSO4 | ZnCl2
(1)
0.3mol
0.2mol
0.1mol
(2)
0.1mol
0.3mol
0.1mol
|
两份营养液中各离子的浓度( )
A.完全相同
B.完全不同
C.仅c(K+)相同
D.仅c(Cl-)相同
参考答案:第一份营养液中,0.3molKCl里面有0.3mol钾离子和0.3mol氯离子,0.2mol硫酸钾里面有0.2mol×2=0.4mol钾离子和0.2mol硫酸根离子,0.1mol硫酸锌里面有0.1mol锌离子和0.1mol硫酸根离子,那么总共此营养液里面有:n(K+)=0.3mol+0.4mol=0.7mol,n(SO42-)=0.2mol+0.1mol=0.3mol,n(Zn2+)=0.1mol,n(Cl-)=0.3mol;
第二份营养液中,0.1molKCl里面有0.1mol钾离子和0.1mol氯离子,0.3mol硫酸钾里面有0.3mol×2=0.6mol钾离子和0.3mol硫酸根离子,0.1mol氯化锌里面有0.1mol锌离子和0.1mol×2=0.2mol氯离子,则第二份营养液内有:n(K+)=0.1mol+0.6mol=0.7mol,n(SO42-)=0.3mol,n(Zn2+)=0.1mol,n(Cl-)=0.1mol+0.2mol=0.3mol;
对比以上可知:因体积相同,两种营养液相同离子的物质的量相同,则两种营养液离子浓度完全相同.
故选A.
本题解析:
本题难度:简单
3、填空题 如图所示是分离混合物时常用的仪器及实验室硫酸试剂标签,回答下列问题:
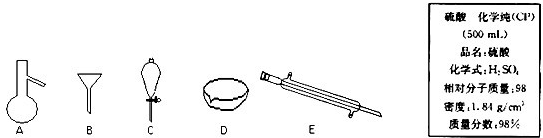
(1)写出仪器C、E的名称______、______.
(2)分离以下混合物应该主要选用使用什么仪器?(填字母符号)粗盐和泥沙:______?花生油和水:______.
(3)计算标签上硫酸的物质的量浓度为______.
参考答案:(1)仪器C、E的名称分别为:分液漏斗、冷凝管,故答案为:分液漏斗、冷凝管;
(2)过滤是把不溶于液体的固体物质跟液体分离开来的一种方法,泥沙不溶于水,粗盐溶于水,可用过滤的方法分离,过滤时用漏斗,故选:B;
根据分液是分离互不相溶的两种液体的方法,花生油和水是互不相溶的两种液体,可用分液的方法分离,分液时用分液漏斗,故选:C;
(3)浓硫酸的物质的量浓度c=1000ρwM=1000×1.84×98%98mol/L=18.4?mol/L,故答案为:18.4?mol/L.
本题解析:
本题难度:一般
4、填空题 实验室需要480mL?0.5mol?L?1的NaOH溶液,配制过程中有如下操作步骤:
①把称量好的NaOH固体放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液小心转入______中;
③继续向容量瓶中加蒸馏水至液面距离刻度l~2cm处,改用胶头滴管小心滴加适量的蒸馏水后停止滴加;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,充分摇匀.
⑥待溶液恢复到室温.
请填写下列空白:
(1)实验操作步骤的正确顺序为(填序号)______.步骤②中该填______.
(2)实验中用托盘天平称取NaOH固体的质量是______.
(3)若实验时出现如下情况,使所配溶液的物质的量浓度偏高的有______.
A.在托盘天平上称取氢氧化钠固体时,将砝码放在天平的左盘,盛有氢氧化钠固体的小烧杯放在天平的右盘.
B.定容时,俯视刻度线.
C.移液后,未洗涤烧杯和玻璃棒.
D.容量瓶中原有少量的蒸馏水
E.前一次配制定容时加水超过了刻度线,所以将溶液倒掉了,后来容量瓶未用蒸馏水润洗,就重新配制溶液.
参考答案:(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,用托盘天平(用到药匙)氢氧化钠,在烧杯中溶解,用玻璃棒搅拌,加速溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以实验操作步骤的正确顺序为①⑥②④③⑤.步骤②中该填500mL容量瓶
故答案为:①⑥②④③⑤;500mL容量瓶.
(2)需氢氧化钠的质量为m=0.5L×0.5mol?L-1×40g/mol=10.0g.
故答案为:10.0g.
(3)A.在托盘天平上称取氢氧化钠固体时,将砝码放在天平的左盘,盛有氢氧化钠固体的小烧杯放在天平的右盘,若 不使用游码,对氢氧化钠质量无影响,对所配溶液浓度无影响.若使用游码,称取氢氧化钠的质量减小,所配溶液浓度偏低;
B.定容时,俯视容量瓶刻度线,使溶液的体积偏低,所以溶液浓度偏高;
C.未洗涤烧杯、玻璃棒,少量氢氧化钠沾在烧杯壁与玻璃棒上,氢氧化钠的实际质量减小,溶液浓度偏低;
D.最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;
E.容量瓶未用蒸馏水润洗,沾有氢氧化钠,氢氧化钠的实际质量增大,所配溶液浓度偏高.
故选:BE.
本题解析:
本题难度:一般
5、选择题 在标准状况下,1体积水中溶解了700体积NH3气,所得溶液的密度为0.9g/cm3,此氨水的物质的量浓度约为( )
A.18.4?mol/L
B.20.4?mol/L
C.0.0446?mol/L
D.31.25?mol/L
参考答案:假定水为1L,氨气为700L,则:
1L水的质量为:1000mL×1g/mL=1000g,
氨气的物质的量为700L22.4L/mol=70022.4mol,氨气的质量为70022.4mol×17g/mol=17×70022.4g
所以氨水的体积为:1000g+17×70022.4g900g/L=224+17×79×22.4L,
故氨水的物质的量浓度为70022.4mol224+17×79×22.4L=18.4?mol/L,
故选A.
本题解析:
本题难度:一般