1、选择题 在标况下,将V?L?A气体(摩尔质量M?g/mol)溶于1L水中,所得A的水溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为
A.
B.
C.
D.
参考答案:A
本题解析:分析:标准状况下,Vm=22.4L/mol,n=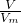 来计算气体的物质的量,利用m=n×M来计算气体的质量,溶剂和溶质的质量和为溶液的质量,利用V=
来计算气体的物质的量,利用m=n×M来计算气体的质量,溶剂和溶质的质量和为溶液的质量,利用V= 来计算溶液的体积,最后利用c=
来计算溶液的体积,最后利用c=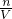 来计算该溶液的物质的量浓度.
来计算该溶液的物质的量浓度.
解答:标准状况下,Vm=22.4L/mol,气体的物质的量为n=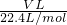 ;
;
气体的质量=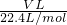 ×Mg/mol=
×Mg/mol=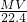 g;
g;
水的质量为1000mL×1g/mL=1000g,
即溶液的质量为1000g+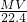 g;
g;
则溶液的体积=
溶液的物质的量浓度=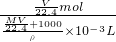 =
=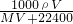 mol/L.
mol/L.
故选A.
点评:本题考查学生利用物质的量浓度的定义式计算,明确溶液中的溶质的物质的量及溶液的体积即可计算,溶液的体积计算是解答本题的关键,并注意本题中应按照气体与水不反应来分析.
本题难度:困难
2、选择题 下列溶液中Cl-的物质的量浓度与50mL 1mol/LAlCl3溶液的物质的量浓度相等的是
[? ]
A.150mL 1mol/L NaCl
B.150mL 3mol/L KCl
C.75mL 2mol/L NH4Cl
D.75mL 1mol/L AlCl3
参考答案:BD
本题解析:
本题难度:简单
3、简答题 实验室需要0.1mol/L氢氧化钠溶液100mL,现有2mol/L氢氧化钠溶液.
(1)计算所需2mol/L氢氧化钠溶液的体积;
(2)完全中和50mL已配制溶液,需要1mol/L的盐酸多少体积?
参考答案:(1)令需要要2mol/L氢氧化钠溶液的体积为V,根据稀释定律,稀释前后溶质氢氧化钠的物质的量不变,则:
2mol/L×V=0.1mol/L×100mL,解得V=5mL,
答:所需2mol/L氢氧化钠溶液的体积为5mL;
(2)50mL0.1mol/L氢氧化钠溶液中氢氧化钠的物质的量为:0.05L×0.1mol/L=0.005mol,根据HCl+NaOH=NaCl+H2O可知参加反应HCl的物质的量为0.005mol,故需要1mol/L的盐酸体积为0.005mol1mol/L=0.005L=5mL,
答:需要1mol/L的盐酸体积为5mL.
本题解析:
本题难度:一般
4、选择题 已知98%的浓硫酸的浓度为18.4mol/L,则49%的硫酸溶液的物质的量浓度( )
A.等于9.2mol/L
B.小于9.2mol/L
C.大于9.2mol/L
D.无法确定
参考答案:设49%的硫酸溶液的浓度为为c,98%的浓硫酸的密度为ρ1,49%的硫酸溶液的密度为ρ2,
则18.4mol/L=1000ρ1×98%98,
c=1000ρ2×49%98,
由硫酸溶液的浓度越大时,其溶液的密度越大,
则ρ1>ρ2,
所以c<9.2mol.L-1,
故选B.
本题解析:
本题难度:一般
5、选择题 含某物质的溶液,其体积为V?mL、密度为ρ?g?mL-1,物质的量浓度为c?mol?L-1,溶质的质量分数为W%,其中溶质为m?g,溶质的相对分子质量为M,则下列表示正确的是( )
A.c=
B.m=
C.W%=
D.c=
参考答案:含某物质的溶液,其体积为V?mL、密度为ρ?g?mL-1,物质的量浓度为c?mol?L-1,溶质的质量分数为W%,其中溶质为m?g,溶质的相对分子质量为M,则:
A.c=1000ρωM=1000×ρ×W%M,质量分数漏掉百分号,故A错误;
B.溶液的质量为根据m(溶液)=ρV,故溶质质量m=ρV×W%=VρW100,故B正确;
C.根据c=1000ρωM可知,W%=cM1000ρ,故C错误;
D.溶质的物质的量为n=mgMg/mol=mMmol,故溶液的物质的量浓度c=mMmolV×10-3L=1000mMVmol/L,故D正确;
故选BD.
本题解析:
本题难度:简单