1、选择题 一定质量的铜、铝混合物与一定体积硝酸溶液恰好完全反应,得硝酸盐溶液和NO2、N2O4、NO的混合气体,这些气体与标准状况下3.36L氧气混合后通入水中,所有气体恰好完全被水吸收生成硝酸.若向所得硝酸盐溶液中加入4mol/LNaOH溶液至沉淀最多停止加入,将所产生沉淀取出,余下溶液加水稀释至600ml,此时所得溶液的物质的量浓度为
A.1mol/L
B.0.5mol/L
C.1.2mol/L
D.2mol/L
参考答案:A
本题解析:分析:金属失去的电子等于氧气与混合气体反应生成硝酸获得的电子,向所得硝酸盐溶液中加入4mol/LNaOH溶液至沉淀最多停止加入,此时溶液为硝酸钠溶液.根据硝酸根守恒可知,钠离子物质的量等于金属失去的电子的物质的量.据此计算钠离子的物质的量,进而计算溶液的浓度.
解答:标准状况下3.36L氧气的物质的量为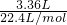 =0.15mol,所以氧气获得电子的物质的量为0.15mol×4=0.6mol.
=0.15mol,所以氧气获得电子的物质的量为0.15mol×4=0.6mol.
金属失去的电子等于氧气与混合气体反应生成硝酸获得的电子为0.6mol.
向所得硝酸盐溶液中加入4mol/LNaOH溶液至沉淀最多停止加入,此时溶液为硝酸钠溶液.根据硝酸根守恒可知,钠离子物质的量等于金属失去的电子的物质的量为0.6mol.所以硝酸钠的物质的量为0.6mol.
稀释至600ml,此时所得溶液的物质的量浓度为 =1mol/L.
=1mol/L.
故选:A.
点评:考查混合物计算、氧化还原反应计算等,难度较大,利用常规方无法解答,是守恒思想在混合计算典型利用,判断金属失去的电子等于氧气获得的电子是关键.
本题难度:简单
2、选择题 下列物质中不含有氯离子的是
A.氯水
B.漂粉精
C.盐酸
D.液氯
参考答案:D
本题解析:分析:含有氯离子的化合物属于离子化合物,是由离子构成,注意混合物中可含氯离子,而液氯为单质,由分子构成,不含氯离子,以此来解答.
解答:A.氯水为混合物,含盐酸电离生成的氯离子,故A不选;
B.漂白精为混合物,含氯化钙,存在氯离子,故B不选;
C.盐酸为混合物,在水溶液中电离出氯离子,故C不选;
D.液氯为单质,由分子构成,不含氯离子,故D选;
故选D.
点评:本题考查物质的构成及电离,注意混合物的成分及物质的构成,液氯为单质,注意氯水与液氯的差别,题目难度不大.
本题难度:一般
3、选择题 现有甲、乙、丙、丁和Fe(OH)3胶体.按甲和乙、乙和丁,丙和丁、乙和Fe(OH)3胶体两两混合.均出现胶体聚沉.则胶体粒子带负电荷的胶体是
A.甲
B.乙
C.丙
D.丁
参考答案:BC
本题解析:分析:氢氧化铁胶体粒子吸附正电荷,带相反电荷的胶体粒子混合会发生聚沉;
解答:氢氧化铁胶体粒子吸附正电荷和乙混合聚沉,说明乙胶体粒子吸附负电荷;甲和乙、乙和丁混合发生聚沉说明甲和丁胶体粒子吸附正电荷;丙和丁混合聚沉丙胶体粒子吸附电荷;所以乙和丙胶体粒子吸附负电荷;
故选BC.
点评:本题考查了胶体性质应用,主要是胶体吸附带电离子发生聚沉的原理,吸附相反电荷的胶体混合会发生聚沉.
本题难度:一般
4、选择题 下列电离方程式书写完全正确的是
A.H2SO4═H++SO42-
B.Ca?(OH)2═Ca2++(OH)22-
C.NaCl═Na++Cl-
D.Al2(SO4)3═Al23++3SO42-
参考答案:C
本题解析:分析:先判断电解质,强电解质用“═”,并遵循电荷守恒、质量守恒定律,注意原子团不能拆分,以此来解答.
解答:A.H2SO4为强电解质,电离方程式为H2SO4═2H++SO42-,故A错误;
B.Ca?(OH)2为强电解质,电离方程式为Ca?(OH)2═Ca2++2OH-,故B错误;
C.NaCl为强电解质,电离方程式为NaCl═Na++Cl-,故C正确;
D.Al2(SO4)3为强电解质,电离方程式为Al2(SO4)3═2Al3++3SO42-,故D错误;
故选C.
点评:本题考查电离方程式的书写,明确电解质的强弱、电离方程式的书写方法、原子团及离子符号等即可解答,题目难度不大.
本题难度:一般
5、选择题 下列物质不能使溴水层褪色的是
A.镁粉
B.苯
C.苯乙烯
D.碘化钾
参考答案:D
本题解析:镁与溴水反应得到溴化镁无色溶液,苯可以发生萃取使水层无色,苯乙烯可以和溴水发生加成反应,得到无色溶液.而碘化钾与溴水发生置换反应以后,得到的碘水也有颜色.
本题难度:一般