1、选择题 常温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+)
D.0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
参考答案:D
本题解析:
本题难度:一般
2、填空题 某可溶性盐化学式为XY(其中X+为阳离子;Y―为阴离子),将一定量的该盐溶于足量的水中。
(1)若测得溶液的pH为3,则该盐溶液中离子浓度大小关系为:___________ ;
(2)若测得溶液的pH为11,则该盐与水反应的离子方程式为:_____________ ;
(3)若测得溶液的pH为13,则取0.1mol/L的HY溶液100mL中和等浓度的NaOH溶液至中性,所需 NaOH溶液的体积_____________100mL(填“>”、“<”、或“=”)。
参考答案:(1) c(Y-)>c(X+)>c(H+)>c(OH-)
(2) Y-+H2O HY+OH-
HY+OH-
(3)<
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是
[? ]
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. 向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中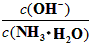 增大
增大
参考答案:C
本题解析:
本题难度:一般
4、选择题 常温下将pH=2的HCl溶液V1?mL与pH=a的氨水V2?mL混合。下列说法正确的是
A.若a=12,混合后溶液pH>7,则V2一定大于V1?
B.若a=12,混合后溶液pH=7,则混合溶液V总>2V2?
C.若V1=V2,且HCl与氨水恰好完全反应,则a>12?
D.若V1=V2,且a=12,则混合溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>
c(OH-)?
参考答案:B
本题解析:
本题难度:一般
5、简答题 化学兴趣小组的同学将Na2SO3在隔绝空气并经600℃以上的强热至恒重,然后对加热后固体进行元素定性定量分析,确定固体组成与Na2SO3无异;但把加热后固体溶于水,得到的溶液pH值比Na2SO3溶液的pH高.
(1)Na2SO3溶液呈______性(填“酸”或“碱”),其原理是(以相关的离子方程式表示)______.
(2)强热后的物质是什么呢?同学作如下探究
①分析猜想:Na2SO3在强热下发生了分解反应(自身氧化还原反应)
②该残留物可能的存在物质:
假设1:______;
假设2:______.
③设计实验方案证明你的假设,请按下表格式完成相关内容.(限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、试管夹;6mol?L-1?HCl、0.1mol?L-1BaCl2、0.1mol?L-1KCl、蒸馏水)
| 实验步骤 | 预期现象和结论
步骤1:取少量固体分别于试管中,加入一定量的蒸馏水溶解
固体全部溶解
步骤2:
步骤3
参考答案:(1)Na2SO3为强碱弱酸盐,SO32-水解呈碱性,水解的离子方程式为SO32-+H2O?

?HSO3-+OH-,
故答案为:碱;SO32-+H2O?

?HSO3-+OH-;
(2)②Na2SO3在强热下发生了自身氧化还原反应,化合价升高可生成Na2SO4,说明化合价降低生成可能生成S或Na2S,产物全部溶于水,得到的溶液pH值比Na2SO3溶液的pH高,
说明生成Na2S,
则有两种可能:如全部发生分解反应,则生成Na2S?和Na2SO4;如部分发生分解反应,则有Na2S、Na2SO3?和Na2SO4存在,
故答案为:Na2S?和Na2SO4;Na2S、Na2SO3?和Na2SO4;
③如固体中含有Na2S和Na2SO3,在酸性条件下发生:SO32-+2S2-+6H+=3S↓+3H2O,则溶液变浑浊,如仅有特殊气味的气体放出,说明固体中含有Na2S,发生:S2-+2H+=H2S↑;
然后取反应后的澄清溶液滴加0.1?mol?L-1BaCl2溶液,若有白色沉淀生成,则说明固体中含有Na2SO4.否则假设1成立,
故答案为:
实验步骤预期现象和结论步骤2:往试管中,加入足量6?mol?L-1?HCl若溶液变浑浊,则说明固体中含有Na2S和Na2SO3;若溶液没有变浑浊,而仅有特殊气味的气体放出,说明固体中
含有Na2S步骤3:取步骤2中的澄清液于试管,然后往试管中加入少量0.1?mol?L-1BaCl2若有白色沉淀生成,则说明固体中含有Na2SO4.结合步骤2,若溶液没有变浑浊,只有气体放出,则假设1成立;若溶液变浑浊,则假设2成立.
本题解析:
本题难度:一般
|