1、选择题 已知某离子的结构示意图为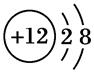 ,下列说法正确的是(?)
,下列说法正确的是(?)
A.该元素位于第二周期第ⅡA族
B.该元素位于第二周期第Ⅷ族
C.该元素位于第三周期第ⅡA族
D.该元素位于第三周期0族
参考答案:C
本题解析:由该离子的结构示意图,可确定该元素原子序数为12,应为镁元素,位于第三周期第ⅡA族。
本题难度:一般
2、填空题 (14分)A、B、C、D、E、F均为短周期元素,原子序数依次递增。A元素原子核内无中子。B元素原子最外层电子数是次外层电子数的2倍。C元素是地壳是含量最多的元素。D是短周期元素中金属性最强的元素。E与F的位置相邻,F的最高价氧化物的水化物为最强的酸。
(1)推断B在元素周期表中的位置:?。
(2)写出A与C形成的10电子的阳离子化学式:?。(用对应的化学符号填空,下同)
(3)E、F两种元素中非金属性较强的是?;用电子式表示D2C形成过程?
(4)D、E形成的正盐的水溶液中,阴离子的浓度大小顺序为:?(从大到小排列)。
(5)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热量,写出反应的热化学方程式:?
(6)甲是A和C按原子个数比1:1组成的化合物。已知甲的溶液能使酸性高锰酸钾溶液褪色。将含有0.5mol甲的溶液滴加到100mL? 2mol/L酸性高锰酸钾溶液中,溶液紫色恰好褪去,该反应的离子方程式为 ?
参考答案:(1) 第二周期?第IVA族?(2)H3O+
(3)Cl?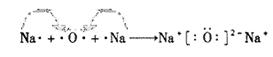 ?
?
(4)C(S2-)>C(OH-)>C(HS-)
(5)H2(g) + 1/2O2(g) ="==" H2O(l)?△H=-286KJ·mol-1 (其他合理答案也对)
(6) 2MnO4-+5H2O2+6H+ = 2Mn2+ +5O2↑+8H2O
本题解析:“A元素原子核内无中子”,则A为11H;B元素的核外电子排布为2 4,则B为碳元素;“C是地壳中含量最多的元素”,则C为氧元素、;“D是短周期中金属性最强的元素”,则D为钠元素;“F与E位置相邻,F的最高价氧化物的水化物为最强的酸。,则F为氯元素、E为硫元素;(1)根据电子层数=周期序数,最外层电子数=主族序数,B在元素周期表中的位置第二周期?第IVA族?;(2)A与C形成的10电子的阳离子化学式:H3O+;(3)E、F两种元素中非金属性较强的是Cl;用电子式表示D2C形成过程 。(4)D、E形成的正盐是硫化钠,其水溶液呈碱性,阴离子的浓度大小顺序为:C(S2-)>C(OH-)>C(HS-)。(5)反应的热化学方程式:H2(g) + 1/2O2(g) ="==" H2O(l)?△H=-286KJ·mol-1;(6)甲是A和C按原子个数比1:1组成的,则甲为过氧化氢。已知甲的溶液能使酸性高锰酸钾溶液褪色,说明被高锰酸钾氧化了,0.5mol甲与0.2mol酸性高锰酸钾溶液恰好反应,即比值为5:2,据此信息则该反应的离子方程式为 2MnO4-+5H2O2+6H+ = 2Mn2+ +5O2↑+8H2O。
。(4)D、E形成的正盐是硫化钠,其水溶液呈碱性,阴离子的浓度大小顺序为:C(S2-)>C(OH-)>C(HS-)。(5)反应的热化学方程式:H2(g) + 1/2O2(g) ="==" H2O(l)?△H=-286KJ·mol-1;(6)甲是A和C按原子个数比1:1组成的,则甲为过氧化氢。已知甲的溶液能使酸性高锰酸钾溶液褪色,说明被高锰酸钾氧化了,0.5mol甲与0.2mol酸性高锰酸钾溶液恰好反应,即比值为5:2,据此信息则该反应的离子方程式为 2MnO4-+5H2O2+6H+ = 2Mn2+ +5O2↑+8H2O。
本题难度:一般
3、简答题 已知M2+3d轨道上有5个电子,试推出:
(1)M原子的核外电子排布。
(2)M原子的最外层和最高能级组中电子数各为多少?
(3)M元素在周期表中的位置。
参考答案:(1)1s22s22p63s23p63d54s2
(2)2? 7
(3)第4周期ⅦB族
本题解析:(1)根据鲍林的轨道近似能级图,3d轨道在第四能级组出现,M必定
为第4周期元素;因3d未充满,4p轨道肯定无电子。该元素失电子时,应
先失4s电子再失3d电子,故M的核外电子排布式为1s22s22p63s23p63d54s2。
(2)M原子最外层有2个电子,即4s2,最高能级组为(4s 3d 4p),共有7个电
子。(3)元素周期的划分是以能级组的划分为内在依据,元素所在周期数等
于核外最高能级电子所在的能级组数,故该元素属第4周期。对于ⅢB~ⅦB
族的价电子数与族数相同,该元素M的价电子排布为3d54s2,价电子数为7,
故M为ⅦB族。
本题难度:简单
4、选择题 在原子结构示意图中,M层最多能排多少电子?
A.2
B.8
C.18
D.32
参考答案:C
本题解析:考查原子的核外电子排布规律,M层最多容纳2×32=18个,答案选C。
本题难度:简单
5、填空题 (本题共8分)在玻璃生产中,熔炉里原料发生的主要反应为:
2Na2CO3+CaCO3+3SiO2 2Na2SiO3+CaSiO3+3CO2↑
2Na2SiO3+CaSiO3+3CO2↑
(1).某反应物在熔融状态下不导电,它属于_____晶体。
(2).上述反应里,在周期表中相邻两元素的原子半径______>______(填元素符号) ,处于同一周期元素的名称是__________________。
(3).上述反应里金属性最强的短周期元素,其原子核外有______种不同能级的电子,其单质在O2中充分燃烧,产物的电子式为_____________。
(4).H2与O2发生反应的过程用模型图示如下(“—”表示化学键):
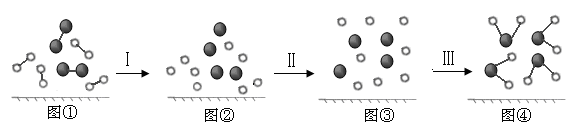
其中过程Ⅰ是______过程(填“吸热”、“放热”或“没有能量变化”)。图④中产生了由极性键构成的__________分子(填“极性”或“非极性”)。
参考答案:(1).原子?(1分)
(2).Si? C? (1分)?碳与氧?钠与硅? (共2分,各1分)?
(3).4?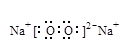 ?(共2分,各1分)
?(共2分,各1分)
(4).吸热 (1分)?极性? (1分)
本题解析:(1).二氧化硅在熔融状态下不导电,是原子晶体。
(2).碳和硅属于同一主族的相邻元素,同主族自上而下原子半径逐渐增大,所以硅原子半径大于碳原子半径。属于同一周期的是碳互为氧以及钠和硅。
(3)金属性最强的是钠,根据构造原理可知,有4种不同能级的电子。钠在氧化中的燃烧产物是过氧化钠,含有离子键和非极性键的离子化合物。
(4).过程I是断键过程,吸热。水是由极性键构成的极性分子。
本题难度:一般