1、填空题 (14分)A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈现的化合价依次递增,其中只有B为单质;
②常温下将气体D通入水中发生反应,生成C和E;
③工业上以A、空气和水为原料,通过催化氧化法制取E。
请回答以下问题:
(1)B的电子式为:______,A的结构式为__________,A分子的空间构型是_______;
(2)写出②中涉及反应的化学方程式_____________________________________。
(3)由B反应生成1 molA放出的热量为46.2kJ,写出该反应的热化学方程式,并注明反应条件____________________________________________________________________。
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式_______________________________________,生成的大量白烟属于_______化合物。
参考答案:(1)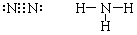 ?三角锥型。
?三角锥型。
(2)3NO2+H2O=2HNO3+NO
(3)N2(g)+3H2(g) ==2NH3(g)?△H =" -92.4" kJ/mol
(4)8NH3+3Cl2=6NH4Cl+N2?离子
本题解析:根据题意找出突破口,E中Y元素的化合价最高,催化氧化法制取E,可以推断出E为硝酸,Y为N,根据A、B、C、D、E中所呈现的化合价依次递增,可以推断分别为NH3、N2、NO、NO2、HNO3。
(1)N2要满足8电子结构,必须要有三对共用电子对,NH3分子的空间构型是三角锥形;
(2)二氧化氮与水反应生成硝酸和一氧化氮,方程式为3NO2+H2O=2HNO3+NO。
(3)生成1 mol NH3放出的热量为46.2kJ,则生成2molNH3放出的热量是92.4 kJ,方程式为N2(g)+3H2(g) ==2NH3(g) ;△H =" -92.4" kJ/mol。
(4)用NH3进行检验时有氮气生成,说明是氯气置换出氮气,生成的氯化氢又结合氨气生成了氯化铵固体小颗粒,是白色的烟;反应的化学方程式8NH3+3Cl2=6NH4Cl+N2,氯化铵是离子化合物。
点评:对于氮气及其化合物的转化要形成网络化,同时通过物质之间的反应要进一步理解氧化还原反应等理论知识。
本题难度:一般
2、选择题 下列说 法中错误的是
法中错误的是
A.熔融状态下能够导 电的化合物中一定存在离子键
电的化合物中一定存在离子键
B.单原子形成的离子,一定与稀有气体原子的核外电子排布相同
C.L层上的电子数为奇数的原子一定是主族元素的原子
D.同一主族的元素的原子,最外层电子数相同,化学性质不一定完全相同
参考答案:B
本题解析:略
本题难度:一般
3、选择题 某元素原子的价电子构型为2s22p5,下列有关该元素的描述正确的有
A.原子序数为7
B.电负性最大
C.原子半径最大
D.第一电离能最大
参考答案:B
本题解析:由核外电子排布式可知,元素是F,是非金属性 最强的非金属元素即电负性最大。所以答案选B。
本题难度:一般
4、选择题 下列关于元素周期表的说法正确的是
A.元素周期表有七个横行,即七个周期
B.元素周期表有十八个竖行,即十八族
C.周期表中有七个主族,十一个副族
D.第ⅠA族又叫卤族
参考答案:A
本题解析:考查元素周期表的结构。元素周期表分为7个主族、7个副族、1个第Ⅷ和1个0族。卤族是指第ⅦA,所以正确的答案是A。
本题难度:简单
5、选择题 下列各项内容中,排列顺序正确的是(?)
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3?②物质的熔点Li>Na>K
③微粒半径:K+>S2->F-?④单质的密度Na<K<Rb?⑤氢化物的沸点:H2Se>H2S>H2O
A.①③
B.②④
C.①②
D.③⑤
参考答案:C
本题解析:①、Na2CO3难分解,CaCO3高温时分解,NaHCO3加热分解,正确;②、碱金属的熔点随着原子序数的增加而减小,正确;③、离子半径大小顺序为:S2?>K+>F?,错误;④、单质的密度顺序为:K<Na<Rb,错误;⑤、氢化物的沸点顺序为:H2O>H2Se>H2S,错误,故C项正确。
本题难度:一般