1、填空题 (6分)写出下列各粒子的化学式
(1)由2个原子组成的具有10个电子的分子??阴离子是?
(2)由4个原子组成的具有10个电子的分子是??阳离子是?
(3)由3个原子组成的具有18个电子分子是??
(4)由5个原子组成的具有10个电子的阳离子是?。
参考答案:HF? OH —? NH3? H3O+? H2S? NH4+
本题解析:考查常见的10电子或18电子微粒。首先确定10电子和18电子的中性原子Ne和Ar,然后找出比它们多或少电子的原子转化成阴、阳离子或氢化物分子。
(1)具有10电子的原子是Ne原子.
(2)其它10电子微粒一般是Ne原子前后的元素通过得失或共用电子对来达到10个电子的.如:
①.Ne原子前面元素的氢化物.有CH4、NH3、H2O、HF.
②.上述氢化物去氢以后形成的阴离子,如:NH2-、N3-、O2-、F-等.
③.上述氢化物加H+后形成的阳离子.如:NH3+H+=NH4+ ,? H2O+H+=H3O+
④.Ne原子后金属元素的阳离子.如:Na+、Mg2+、Al3+等.
2、基团? -F、-OH、-NH2、-CH3(均含9个电子),两个自身合并或两两之间交换组合均可得到含18电子的微粒。
本题难度:一般
2、选择题 日本福岛核电站发生核泄漏,对周围土地、海域产生影响。我国东部沿海地区先后检测出放射性物质131I,含量较低,对人们的生活、健康没有造成影响。下列对131I的叙述错误的是
A.131I的质量数为131
B.1mol 131I的质量为131
C.131I和127I互为同位素
D.131I核外最外层电子数为7
参考答案:B
本题解析:具体的原子表示方法为A Z X;其中A为质量数,Z为质子数,A—Z=N(中子数);
A正确,131I的质量数为131;B错,1mol 131I的质量为131g;C正确,同位素是指质子数相同,而中子数不同的同一元素的不同原子;D正确,131I为卤素,最外层有7个电子;
本题难度:一般
3、选择题 重水(D2O)是重要的核工业原料,下列说法错误的是
A.氘(D)原子核外有1个电子? B.1H与D互称同位素
C.H2O与D2O互称同素异形体? D.1H218O与D216O的相对分子质量相同
参考答案:C
本题解析:A、氘(D)原子核电荷数为1,核外有1个电子,正确;B、1H与D质子数相同,中子数不同互称同位素,正确;C、H2O与D2O均为水分子,同素异形体是指同种元素构成的不同单质,错误;D、1H218O的相对分子质量为1×2+18=20,D216O的相对分子质量为2×2+16=20,正确。
本题难度:简单
4、选择题 已知A、B、C、D的原子序数都不超过18,它们的离子aA(n+1)+、bBn+、cC(n+1)-、dDn-均有相同的电子层结构,则下列叙述正确的是( )
A.原子序数:a>b>c>d? B.离子还原性:A(n+1)+>Bn+,离子氧化性:C(n+1)->Dn- ?
C.离子半径:A(n+1)+>Bn+>C(n+1)->Dn-?D.单质还原性:B>A,单质氧化性:D>C
参考答案:D
本题解析:略
本题难度:一般
5、选择题 X元素原子的质量数为m,核内中子数为n,则Wg X2+ 离子含有的电子的物质的量约为( )
A.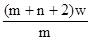 mol
mol
B.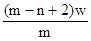 mol
mol
C.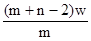 mol
mol
D.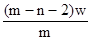 mol
mol
参考答案:D
本题解析:X元素的原子序数是m-n,则X2+ 离子的电子数是m-n-2。所以Wg X2+ 离子含有的电子的物质的量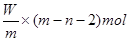 ,所以答案是D。
,所以答案是D。
本题难度:一般