|
|
|
高中化学必备知识点《物质的量》考点特训(2019年冲刺版)(三)
2019-06-28 22:32:44
【 大 中 小】
|
1、实验题 (12分)实验室需要配制0.1 mol/L NaOH溶液450 mL,回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)
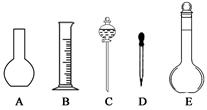
(2)下列操作中,容量瓶所具备的功能有 (填序号)。
A.贮存溶液
B.配制一定体积准确浓度的标准溶液
C.测量容量瓶规格以下的任意体积的液体
D.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为 g;
(4)取用任意体积的所配0.1 mol/L NaOH溶液时,下列物理量中不随所取体积的多少而变化的是(填字母) ;
A.溶液中NaOH的物质的量 B.溶液的浓度
C.溶液中Na+的数目 D.溶液的密度
(5)将所配制的NaOH溶液进行测定,发现浓度大于0.1 mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容;
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
2、填空题 在 NaCl与MgCl2的混合液中,Na+与Mg2+的物质的量之比为1:2。如果混合液中共有0.5 mol Cl-,溶液的体积为0.5 L,则混合液中氯化钠的质 量为?;MgCl2的物质的量浓度为?。 量为?;MgCl2的物质的量浓度为?。
3、选择题 设NA为阿伏加德罗常数的值。下列叙述正确的是
A.常温下,23 g NO2含有氧原子的数目为NA
B.1.00 mol·L-1 NaCl溶液中含有Na+的数目为NA
C.标准状况下,39 g苯中含有的碳碳双键数为1.5NA
D.常温常压下,22.4 L乙烯中含C-H键的数目为4NA
|
4、实验题 (11分)用18 mol/L 的浓硫酸配制100 mL 3.0 mol/L 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积?②量取一定体积的浓硫酸?③溶解?
④检漏、转移、洗涤?⑤定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是?,量取浓硫酸所用的量筒的规格是?(用下列编号填空)。
A.10ml
B.25ml
C.50ml
D.100ml
|
(2)第③步实验的操是
?。
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线
?;改用
?向容量瓶中滴加蒸馏水至
?为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(4)转移溶液和直接加蒸馏水于容量瓶中要注意“两靠”:一靠是盛溶液的烧杯口靠在玻璃棒上部,二靠是玻璃棒下端靠在
?。
(5)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”、“偏小”、“无影响”填写)
①容量瓶用蒸馏水洗涤后残留有少量的水
?;
②所用过的烧杯、玻璃棒未洗涤
?;
③加水超过刻度线后,用胶头滴管吸出多余的液体
?。
5、计算题 (10分)(1)12.4 g Na2X含有0.4 mol Na+,Na2X的摩尔质量为_____,其相对分子质量为______,X的相对原子质量为________,该物质的化学式为________。
(2)相同状况下,一定体积的气态氢化物HmX的质量是等体积NH3的2倍。则X的相对原子质量为________。(用含m的代数式表示)
(3)a个X原子的总质量为b g,则X的相对原子质量可表示为________。
(4)20 g A物质和14 g B物质完全反应,生成8.8 g C物质、3.6 g D物质和0.2 mol E物质,则E物质的摩尔质量为________。
(5)483 g Na2SO4·10H2O中所含的Na+的物质的量是?mol,SO42—的物质的量是?mol,所含O原子的数目是?个。