| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《物质的量》考点特训(2019年冲刺版)(四)
参考答案:A 本题解析:A.常温下,23 g NO2的物质的量是0.5mol,故含有氧原子的数目为NA,正确;B.只有溶液的浓度而没有溶液的体积,因此不能确定微粒数目的多少,错误;C标准状况下,39 g苯的物质的量是0.5mol,,但是苯分子中没有碳碳双键,是一种介于碳碳单键和碳碳双键之间的一种独特的化学键,错误;D.常温常压下,22.4 L乙烯的物质的量小于1mol,因此其中含C-H键的数目小于4NA,错误。 本题难度:一般 4、实验题 (11分)用18 mol/L 的浓硫酸配制100 mL 3.0 mol/L 稀硫酸的实验步骤如下: |
参考答案:(11分)(除(2)为2分外,其他每空各1分。)(1)16.7mL? B?
(2)向烧杯中加入适量蒸馏水,将浓硫酸沿烧杯内壁缓缓加入水中,并用玻璃棒不断搅拌
(3)1—2cm处?胶头滴管?液面与刻度线相切
(4)容量瓶瓶颈刻度线以下的内壁上
(5)无影响;偏小;偏小
本题解析:(1)根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18mol/L=100mL×3.0mol/L,解得:x≈16.7,所需浓硫酸的体积为16.7mL.
根据提供的量筒规格,所以应选择25mL量筒。
故答案为:16.7mL;B.?
(2)浓硫酸稀释操作:把浓硫酸沿烧杯壁缓慢倒入盛水的烧杯中,不断用玻璃棒搅拌散热,防止溶液飞溅而烫伤操作者.
故答案为:把浓硫酸沿烧杯壁缓慢倒入盛水的烧杯中,不断用玻璃棒搅拌散热.
(3)定容操作为:继续向容量瓶加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀.
故答案为: 1~2cm时,胶头滴管,?溶液凹液面与刻度线水平相切,
(4)玻璃棒靠在容量瓶瓶颈刻度线以下的内壁上,可以实现液体不在刻度线以上存在有液体悬挂,也就是达到液体测量最精确。
(5)①最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;
②烧杯、玻璃棒未进行洗涤,少量硫酸沾在烧杯壁与玻璃棒上,移入容量瓶中硫酸的实际物质的量减小,所配溶液浓度偏小;
③定容时加蒸馏水不慎超过了刻度,导致溶液体积增大,所配溶液浓度偏小.
故答案为:无影响;偏小;偏小.
点评:本题考查了一定物质的量浓度溶液的配制,难度不大,会根据量取浓硫酸的体积选择量筒。
本题难度:一般
5、计算题 (10分)(1)12.4 g Na2X含有0.4 mol Na+,Na2X的摩尔质量为_____,其相对分子质量为______,X的相对原子质量为________,该物质的化学式为________。
(2)相同状况下,一定体积的气态氢化物HmX的质量是等体积NH3的2倍。则X的相对原子质量为________。(用含m的代数式表示)
(3)a个X原子的总质量为b g,则X的相对原子质量可表示为________。
(4)20 g A物质和14 g B物质完全反应,生成8.8 g C物质、3.6 g D物质和0.2 mol E物质,则E物质的摩尔质量为________。
(5)483 g Na2SO4·10H2O中所含的Na+的物质的量是?mol,SO42—的物质的量是?mol,所含O原子的数目是?个。
参考答案:(10分,每空1分)(1)62g/mol? 62? 16? Na2O? (2)34-m? (3)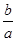 NA
NA
(4)108g/mol? (5)3? 1.5? 21NA
本题解析:考查物质的量的有关计算。
(1)12.4 g Na2X含有0.4 mol Na+,则化合物的物质的量是0.2mol,所以该化合物的摩尔质量是12.4g÷0.2mol=62g/mol;其相对分子质量是62,X的相对分子质量是62-23×2=16,所以X是O,则该化合物是Na2O。
(2)相同状况下,一定体积的气态氢化物HmX的质量是等体积NH3的2倍,则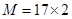 ,解得M=34,所以X原子的相对原子质量是34-m。
,解得M=34,所以X原子的相对原子质量是34-m。
(3)根据M=m/n和 可知,X的相对原子质量可表示为
可知,X的相对原子质量可表示为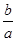 NA。
NA。
(4)根据质量守恒定律可知,E物质的质量是20g+14g-8.8g-3.6g=21.6g,所以E的摩尔质量是21.6g÷0.2mol=108g/mol。
(5)483 g Na2SO4·10H2O的物质的量是483g÷322g/mol=1.5mol,则钠离子的物质的量是3.0mol,SO42-的物质的量是1.5mol。氧原子的物质的量是14×1.5mol=21mol,原子数个数是21NA。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《无机非金属.. | |