1、实验题 (16分)溴水和氯化铁溶液均是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色。在探究铁的化合物相互转化时,进行下列实验。
实验操作:向足量20 mL的FeSO4溶液中,滴入几滴浓溴水,振荡。
实验现象:溶液由浅绿色变成黄色。
(1)对该实验现象的解释:
①如果发生了化学反应,则使溶液呈黄色的微粒是?(填化学式,下同);
②如果未发生化学反应,则使溶液呈黄色的微粒是?。
(2)通过进一步实验,可证明Br2水和FeSO4溶液是否发生反应。下列是设计的一些实验方案和预测。请填空:
?
| 操作
| 预期现象及结论
|
方案1
| 取少量黄色溶液,加入NaOH溶液
| 如果生成红褐色沉淀,则说明发生了反应
|
方案2
| 取少量黄色溶液,加入淀粉碘化钾溶液
| 如果溶液变蓝色,则说明未发生反应
|
方案3
| 取少量黄色溶液,加入四氯化碳,振荡
| 如果下层溶液呈橙红色,则说明:
?
|
①方案1是否合理??(填“合理”或“不合理”)。
方案2中,由于存在反应?(用离子方程式表示),所以预测结论不正确。
②请你另外设计一个合理方案,证明已经反应。将有关内容填入下表。
实验操作
| 预期现象及结论
| 解释现象的离子方程式
|
?
| ?
| ?
参考答案:(16分)
(1)①Fe3+?(2分)?②Br2?(2分)
(2)未发生反应(2分)
①不合理?(2分)? 2 Fe3+ + 2 I-="=" 2 Fe2+?+ I2?(2分)
②(6分)
实验操作
预期现象及结论
解释现象的离子方程式
取少量黄色溶液,
滴加KSCN溶液
溶液变为红色,则说明发生了反应
Fe3++ 3SCN-=Fe(SCN)3
本题解析:略
本题难度:一般
2、选择题 验证某有机物中含有氧元素,应完成的实验内容是(?)
A.只有验证它完全燃烧后产物只有H2O和CO2
B.测定该试样的质量及该试样完全燃烧后生成CO2和H2O的质量
C.测定完全燃烧时消耗有机物与生成的CO2、H2O的物质的量之比
D.只有测定其燃烧产物中H2O和CO2物质的量的比值
参考答案:B
本题解析:略
本题难度:简单
3、简答题 已知稀溴水和氯化铁溶液都呈黄色.现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究.
(1)限选用的试剂有:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉-碘化钾溶液.请完成以下实验探究过程:
【提出假设】
假设1:溶液呈黄色不是发生化学反应所致,是溶液中______引起的(填微粒的化学式,下同).
假设2:溶液呈黄色是发生化学反应所致,是溶液中______引起的.
【设计实验方案】
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:
假设1方案:______.
假设2方案:______.
(2)若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为______.
参考答案:(1)由于稀溴水和氯化铁溶液都呈黄色,假设1、假设2分别探究溶液显示红色的原因,
对于假设1,可以使用四氯化碳碱性检验,若是存在溴单质,静置后下层呈橙红色,
对于假设2,可以采用检验铁离子的方法检验,向溶液中加入硫氰化钾溶液,若是变成血红色,说明存在铁离子,
故答案为:Br2; Fe3+;向黄色溶液中加入CCl4,振荡,静置,下层溶液呈橙红色;向黄色溶液中滴加KSCN溶液,溶液变为血红色;
(2)由于氯气是足量的,溴化亚铁中的溴离子和亚铁离子都会被氯气氧化,反应的离子方程式是:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,
故答案为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-.
本题解析:
本题难度:一般
4、实验题 某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态))
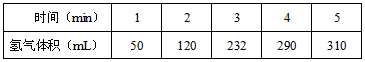
(1)哪一时间段___________(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大,原因是_____________。
(2)哪一段时段的反应速率最小__________________,原因是_________________________。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)______________。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号)________________。
参考答案:(1)2~3min;因为该反应是放热反应,2~3min时温度高
(2)4~5min;因为4~5min是H+浓度小
(3)0.1 mol/(L·min)
(4)AB
本题解析:
本题难度:一般
5、实验题 (16分)为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案。请回答每个方案中提出的问题。
【方案I】
(1)称取碳酸钙样品M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积V mL。
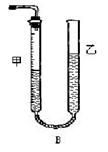
问题1:反应结束后,量气管中的显示如右图所示,接下来的操作是:?,读出甲管中液面的读数。
【方案II】
(1)称取碳酸钙样品M g;
(2)用c mol/L 盐酸V mL(过量)溶解样品;
(3)取溶解后的溶液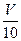 mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。 mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
问题2:列出本实验中所用到的主要仪器名称(除铁架台及附件、烧杯之外)?。
问题3:碳酸钙纯度计算公式?。
问题4:当碳酸钙溶解完全后,少量未溶的SiO2没过滤去,结果得到碳酸钙纯度________?(偏大、偏小或无影响)
【方案Ⅲ】
(1)称取碳酸钙样品M g;
(2)加入足量c mol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量c′ mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题5:此方案中不需要的数据是?(填选项编号)。
A.c、V
B.c′、 V′
C. M′
D. M
|
问题6:为减少实验误差,步骤(3)、(5)过滤后都要对沉淀进行洗涤,如果步骤(3)未经洗涤,则测定的碳酸钙的纯度将?(偏大、偏小、无影响,下同);如果步骤(5)未经洗涤,则测定的碳酸钙纯度将?。
问题7:判断步骤(4)中Na2CO3溶液是否过量的方法是??。
参考答案:
问题1:向下移动乙管,使甲、乙两管中的液面持平?(2分)
问题2:托盘天平、酸式滴定管(或移液管)、碱式滴定管、锥形瓶、药匙(4分)
问题3: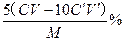 ?(3分)
?(3分)
问题4:无影响?(1分)
问题5:A、B?(2分)
问题6:偏小?偏大?(2分)
问题7:静置后,往上层清液中滴加Na2CO3溶液,若没有白色沉淀生成,则Na2CO3溶液过量?(2分)
本题解析:略
本题难度:简单