1、填空题 结构化学家鲍林(Pauling)曾提出一条经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基氧的原子数。而含氧酸的强弱与非羟基氧原子数(m-n)有如下关系:
(m-n)? 0? 1? 2? 3
含氧酸强度?弱酸?中强?强?很强
实例? HClO? H3PO4? HNO3? HClO4
请回答:
(1)按此规则判断:H3AsO4,H2SO4,HMnO4三处酸性由强到弱的顺序是_________。
(2)H3PO3和H3AsO3的分子组成相似,但酸性强弱相差很大,已知H3PO3为中强酸而H3AsO3为弱酸,试推断它们的结构式,H3PO3为__________,H3AsO3为_________。
参考答案:(1)HMnO4>H2SO4>H3AsO3
(2)
本题解析:略
本题难度:一般
2、选择题 下列气态氢化物最稳定的是
A.HCl
B.HBr
C.HF
D.H2O
参考答案:C
本题解析:略
本题难度:简单
3、选择题 第二次世界大战期间,某国的侦察小分队发现了德国法西斯一座十分隐蔽而且戒备森严的军火工厂,上级要求在三天内必须炸掉它,结果他们用十多只涂有化学试剂的老鼠完成了任务。据你推测这种化学试剂是(?)
A.浓HNO3
B.KMnO4和H2SO4
C.黑火药和炸药
D.白磷和CS2溶液
参考答案:D
本题解析:利用了白磷可溶于CS2及CS2易挥发、白磷易自燃的性质,从而引爆军火工厂。
本题难度:简单
4、实验题 某实验小组同学探究铜与硝酸的反应。
(1)用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10 mL硝酸溶液分别与铜片反应,实验记录如下:
序号
| 浓硝酸与水的体积比
| 实验现象
|
Ⅰ
| 1:1
| 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色
|
Ⅱ
| 1:3
| 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色
|
Ⅲ
| 1:5
| 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色
|
?
铜与稀硝酸反应的离子方程式为?;若生成标准状况下0.56 L NO气体,反应中被还原的HNO3的质量为?g(小数点后保留两位有效数字)。
依据上表,制备NO气体最适宜的是实验II,理由是?。
(2)为防止有毒气体逸散造成空气污染,该小组同学改进实验装置,如右图所示(夹持仪器略去)。
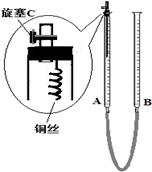
用该装置进行铜与稀硝酸的反应并验证产生NO气体的性质,实验步骤如下:
Ⅰ.安装好装置后,检查装置气密性。
Ⅱ.打开旋塞C,从B管上端加入所选浓度的硝酸,至铜丝下沿(不接触铜丝)。
Ⅲ.向上移动B管,使A管液面上升至与橡皮塞恰好接触,关闭旋塞C,反应开始。
Ⅳ.当液面重新下降至与铜丝脱离接触时,反应停止。
Ⅴ.打开旋塞C,向下移动B管,使A中迅速进入少量空气,关闭旋塞C,观察现象。
……
①步骤Ⅰ中检查装置气密性的操作是:关闭旋塞C,从B管上端加入水,若观察到?,说明装置的气密性良好。
②步骤Ⅲ操作的目的是?。
③为使A管内的NO气体完全被溶液吸收,可进一步采取的操作是?,能确定NO完全被溶液吸收的现象是?。
参考答案:(1)①3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑+ 4H2O? 1.58
②产物是NO,反应速率较快(不用加热)。
(2)①A、B间形成液面差,且保持不变
② 赶走液面上方空气,防止NO被空气中的O2氧化,以便观察生成气体的颜色。
③重复步骤Ⅴ的操作(或答“向下移动B管,使A中迅速进入空气,关闭旋塞C,待气体变为红棕色,反复上述操作”)。
再次重复操作后气体不再变为红棕色。
本题解析:(1)①铜与稀硝酸反应的离子方程式为3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑+ 4H2O ;
8HNO3 (全部)? ~? 2HNO3 (被还原)? ~? 2NO
2×63g? 2×22.4L
1.58 g? 0.56 L ?
②依据上表,制备NO气体最适宜的是实验II,理由是产物是NO,反应速率较快(不用加热)。
(2)①步骤Ⅰ中检查装置气密性的操作是:关闭旋塞C,从B管上端加入水,若观察到A、B间形成液面差,且保持不变 ,说明装置的气密性良好。
② 步骤Ⅲ操作的目的是 赶走液面上方空气,防止NO被空气中的O2氧化,以便观察生成气体的颜色。
③为使A管内的NO气体完全被溶液吸收,可进一步采取的操作是重复步骤Ⅴ的操作(或答"向下移动B管,使A中迅速进入空气,关闭旋塞C,待气体变为红棕色,反复上述操作")。能确定NO完全被溶液吸收的现象是再次重复操作后气体不再变为红棕色。
本题难度:困难
5、选择题 科学家预测,氨有望取代氢能,成为重要的新一代绿色能源。下列有关说法不正确的是
A.液氨作为清洁能源的反应原理是4NH3+5O2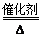 4NO+6H2O
4NO+6H2O
B.液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏
C.氨气比空气轻,标准状况下密度约为0.76 g·L-1
D.氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全
参考答案:A
本题解析:A、液氨作为清洁能源的反应原理是液氨在纯氧中完全燃烧生成水和氮气,所以的化学方程式为4NH3+3O2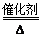 2N2+6H2O,A不正确;B、液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏,B正确;C、氨气的相对分子质量小于空气的,因此氨气比空气轻,标准状况下密度约为17g/mol÷22.4L/mol=0.76 g·L-1,C正确;D、氢气是可燃性气体,燃烧易发生爆炸,因此氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全,D正确,答案选A。
2N2+6H2O,A不正确;B、液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏,B正确;C、氨气的相对分子质量小于空气的,因此氨气比空气轻,标准状况下密度约为17g/mol÷22.4L/mol=0.76 g·L-1,C正确;D、氢气是可燃性气体,燃烧易发生爆炸,因此氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全,D正确,答案选A。
本题难度:一般