1、填空题 物质在水溶液中存在的电离平衡、水解平衡和沉淀溶解平衡,都可看作化学平衡。请根据所学知识回答:
(1)在0.1mo1·L-1的NaHSO3溶液中存在的各种平衡体系为(用离子方程式表示):?、?、?。
已知该溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO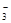 )>c(SO
)>c(SO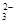 )>c(H2SO3)。则该溶液中c(H+)?c(OH-) (填“大于”、“小于”或“等于”),简述理由:?.
)>c(H2SO3)。则该溶液中c(H+)?c(OH-) (填“大于”、“小于”或“等于”),简述理由:?.
(2)常温下,某水溶液中存在的离子有:Na+、A—、H+、OH—,若该溶液由0.1mo1.L-1的HA溶液和0.1mol.L-1的NaOH溶液等体积混合而得,则溶液的pH ?(填“大于”、“小于”或“等于”)7,理由是?。
参考答案:(1) H2O H++OH- ; HSO3-
H++OH- ; HSO3- H++SO32-; HSO3-+H2O
H++SO32-; HSO3-+H2O H2SO3+OH- ; 大于; 在NaHSO3溶液中存在HSO3-的电离(HSO3-
H2SO3+OH- ; 大于; 在NaHSO3溶液中存在HSO3-的电离(HSO3- H++SO32-)和水解(HSO3-+H2O
H++SO32-)和水解(HSO3-+H2O H2SO3+OH-),由题给信息c(SO32-)>c(H2SO3)知电离比水解程度大,所以c(H+)>c(OH-) (回答出电离大于水解即可);
H2SO3+OH-),由题给信息c(SO32-)>c(H2SO3)知电离比水解程度大,所以c(H+)>c(OH-) (回答出电离大于水解即可);
(2)大于或等于;若HA是强酸,pH=7,若HA是弱酸,pH>7。
本题解析:(1)在0.1mo1·L-1的NaHSO3溶液中存在的各种平衡体系有电离平衡:H2O H++OH- ;? HSO3-
H++OH- ;? HSO3- H++SO32-和水解平衡:HSO3-+H2O
H++SO32-和水解平衡:HSO3-+H2O H2SO3+OH-。由于在该溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),说明HSO3-电离作用大于水解作用。因为在溶液中在NaHSO3溶液中存在HSO3-的电离(HSO3-
H2SO3+OH-。由于在该溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),说明HSO3-电离作用大于水解作用。因为在溶液中在NaHSO3溶液中存在HSO3-的电离(HSO3- H++SO32-)和水解(HSO3-+H2O
H++SO32-)和水解(HSO3-+H2O H2SO3+OH-),由题给信息c(SO32-)>c(H2SO3)知电离比水解程度大,所以c(H+)>c(OH-)。(2)若HA为强酸,则c(H+)=c(OH-).溶液显中性,pH=7;若HA为弱酸,则c(H+)<c(OH-).溶液显碱性,pH>7。
H2SO3+OH-),由题给信息c(SO32-)>c(H2SO3)知电离比水解程度大,所以c(H+)>c(OH-)。(2)若HA为强酸,则c(H+)=c(OH-).溶液显中性,pH=7;若HA为弱酸,则c(H+)<c(OH-).溶液显碱性,pH>7。
本题难度:一般
2、选择题 在0.01mol/L醋酸中加入少量硫酸后,其变化结果是( )
A.氢离子浓度变小
B.醋酸的浓度减小
C.酸性增强,PH变大
D.醋酸根离子浓度变小
参考答案:A.加入少量硫酸后,硫酸溶液中的氢离子量远远大于抑制醋酸电离的氢离子的量,所以混合溶液中氢离子浓度增大,故A错误;
B.加入硫酸后,平衡向左移动,抑制醋酸的电离则溶液中醋酸分子的量增大,所以醋酸浓度增大,故B错误;
C.加入硫酸后,溶液中氢离子浓度增大,溶液的pH减小,故C错误;
D.加入硫酸后,氢离子浓度增大而抑制醋酸的电离,所以溶液中醋酸根离子浓度变小,故D正确.
故选D.
本题解析:
本题难度:简单
3、选择题 氨水有下列平衡NH3·H2O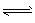 NH4++ OH-,当其他条件不变时,改变下列条件,平衡向左移,且 c( NH4+)增大的是
NH4++ OH-,当其他条件不变时,改变下列条件,平衡向左移,且 c( NH4+)增大的是
[? ]
A.加NaOH
B.加盐酸
C.加NH4Cl
D.加同浓度氨水
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列说法中错误的是
[? ]
A.同浓度的强酸溶液的导电性一定比弱酸的强
B.强酸和强碱一定是强电解质,不管其水溶液浓度的大小,能完全电离
C.强极性共价化合物不一定都是强电解质
D.多元酸、多元碱的导电性一定比一元酸、一元碱的导电能力强
参考答案:AD
本题解析:
本题难度:简单
5、选择题 已知相同温度下电离常数Ki(HF)>Ki(HCN)。在物质的量浓度均为0.1mol/L的NaCN和NaF混合溶液中,下列关系正确的是
A.c(F-)>c(OH-)>c(HCN)>c(HF)
B.c(F-)+c(HF)>c(CN-)+ c(HCN)
C.c(OH-)>c(F-)>c(CN-)>c(H+)
D.c(OH-)>c(HF)>c(HCN)>c(H+)
参考答案:A
本题解析:由于电离常数Ki(HF)>Ki(HCN),根据越弱越水解可知,c(HCN)>c(HF),排除D
再有:CN-+H2O HCN+OH-? F-++H2O<=HF+OH-? H2O
HCN+OH-? F-++H2O<=HF+OH-? H2O H++OH-
H++OH-
可知:c(OH-)>c(HCN)>c(HF)
在盐溶液中,阴、阳离子为主要离子,故c(F-)>c(OH-)>c(HCN)>c(HF),选项A正确,排除C
根据物料守恒可知:c(Na+)=c(F-)+c(HF)=c(CN-)+ c(HCN),排除B
本题难度:困难