1、选择题 下列有关平衡常数说法正确的是( )
A.温度越高,K值越大
B.K值越大,反应的转化率越小
C.K值越大,反应的转化率越大
D.K值的大小与起始浓度有关
参考答案:C
本题解析:
本题难度:一般
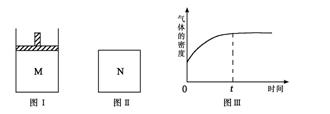
2、选择题 在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+ B(?) xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是? (? )
xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是? (? )
A.x=4?
B.若N中气体的密度如图Ⅲ所示,则A、B都是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
参考答案:C
本题解析:略
本题难度:一般
3、填空题 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化的主要化学反应方程式为:___________________________。
(2)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)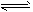 CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)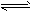 CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g) CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)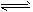 CH3OCH3(g) + CO2(g)的ΔH= ___________;K=?______? (用包含K1、 K2、 K3的式子表示)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
CH3OCH3(g) + CO2(g)的ΔH= ___________;K=?______? (用包含K1、 K2、 K3的式子表示)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)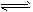 CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH , 反应到某时刻测得各组分的浓度如下
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH , 反应到某时刻测得各组分的浓度如下

① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率
v(CH3OH) = __________。
参考答案:(1)C+H2O CO+H2
CO+H2
(2)-246.4kJ·mol-1;K12·K2· K3 ;ce
(3)①>;②0.04 mol·L-1;0.16 mol·L-1·min-1
本题解析:
本题难度:一般
4、填空题 (14分)将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)  2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
HI体积分数
| 1min
| 2min
| 3min
| 4min
| 5min
| 6min
| 7min
|
条件I
| 26%
| 42%
| 52%
| 57%
| 60%
| 60%
| 60%
|
条件II
| 20%
| 33%
| 43%
| 52%
| 57%
| 65%
| 65%
|
(1)在条件I到达平衡时,计算该反应的平衡常数K,要求列出计算过程。
(2)在条件I从开始反应到到达平衡时,H2的反应速率为____________。
(3)为达到条件II的数据,对于反应体系可能改变的操作是_______________。
(4)该反应的△H_____0(填">","<"或"=")
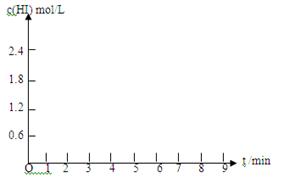
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半。请在图中画出c(HI)随时间变化的曲线。
参考答案:(1)设I2消耗浓度为x
I2(g) + H2(g)  2HI(g)
2HI(g)
起始浓度(mol/L): 0.8 1.2 0
转化浓度(mol/L): x x 2x
平衡浓度(mol/L):0.8-x 1.2-x 2x (2分)
(三行中的数值无浓度或量的单位示意扣1分)
HI的体积分数为60%,则:2x/2=60%,x="0.6" mol/L (1分)
K=c2 (HI) /[c(H2)·c(I2)]=1.22/(0.2×0.6)=12 (1分)
(2)0.12 mol/(L·min) (2分,单位错扣1分)
(3)降低温度 (2分)
(4)< (2分)
(5) (4分,两段各2分)
本题解析:(1)根据化学平衡计算平衡时各物质的浓度,设I2消耗浓度为x
I2(g) + H2(g)  2HI(g)
2HI(g)
起始浓度(mol/L): 0.8 1.2 0
转化浓度(mol/L): x x 2x
平衡浓度(mol/L):0.8-x 1.2-x 2x
HI的体积分数为60%,则:2x/2=60%,x="0.6" mol/L,再根据平衡常数的计算公式K=c2 (HI) /[c(H2)·c(I2)]进行计算,K=1.22/(0.2×0.6)=12。(2)氢气的反应速率=0.6/5=0.12mol/(L·min)。(3)根据表格分析,相同时间内,碘化氢的体积分数变化小,说明速率慢,温度低。(4)平衡时碘化氢的体积分数大,说明降温平衡正向移动,△H<0。(5) 体积压缩到原来一半,则碘化氢的浓度变成原来2倍,平衡不移动,所以图像为:

考点:化学平衡状态的计算和判定。
本题难度:困难
5、选择题 下列图示与对应的叙述相符的是

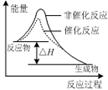

图甲 图乙 图丙 图丁
A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
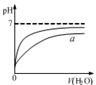
B.图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C.图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D.图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系