1、选择题 在元素周期表主族元素中。甲元素与乙、丙、丁三元素紧密相邻。甲、乙的原子序数之和等于丙的原子序数。这四种元素原子的最外层电子数之和为20。下列判断正确的是
A.原子半径:丙>乙>甲>丁
B.丁或甲与乙所形成的化合物都是有毒的物质
C.最高价氧化物的对应水化物的酸性:丁>甲
D.气态氢化物的稳定性:甲>丙
参考答案:D
本题解析:
根据题意要求知甲为原子序数为7的氮元素,乙为氧元素,丙为磷元素,则丁为碳元素。A项原子半径丙>丁>甲>乙;B项,乙和丁形成的CO2不是大气污染物;C项,最高价氧化物对应水化物的酸性甲>丁;D项,气态氢化物的稳定性甲>丙,故选D。
本题难度:一般
2、选择题 下列电子式不正确的是
A.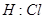
B.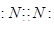
C.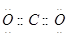
D.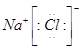
参考答案:A
本题解析:氯化氢中氯原子还存在不参与成键的电子,正确的电子式为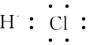 ,其余都是正确的,答案选A。
,其余都是正确的,答案选A。
本题难度:简单
3、填空题 (15分)
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是?,写出一种工业制备单质F的离子方程式?。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为?,其水溶液与F单质反应的化学方程式为?;在产物中加入少量KI,反应后加人CC14并振荡,有 机层显?色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
物质
| 组成和结构信息
|
a
| 含有A的二元离子化合物
|
b
| 含有非极性共价键的二元离子化合物,且原子数之比为1:1
|
c
| 化学组成为BDF2
|
d
| 只存在一种类型作用力且可导电的单质晶体
|
a的化学式为?;b的化学式为?;;c的电子式为?;
d的晶体类型是?。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过?键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为?。
参考答案:
⑴第一周期IA族?2Cl- +2H2O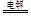 2OH- +H2↑+C12↑(或2NaCl(熔融)
2OH- +H2↑+C12↑(或2NaCl(熔融)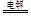 2Na+Cl2。↑(每空2分)
2Na+Cl2。↑(每空2分)
⑵纯碱(或苏打)(1分) 2Na2CO3+Cl2+H2O = NaClO+NaCl+2NaHCO3? ( 2分)紫(1分)
⑶NaH (1分) Na2〇2和Na2C2 ( 2分)?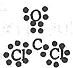 ?(1分)?金属晶体(1分)
?(1分)?金属晶体(1分)
⑷氢(1分)正四面体(1分)
本题解析:根据“非金属元素A最外层电子数与其周期数相同”确定A为氢元素,然后根据其它信息推出B为碳元素,D为氧元素,E为钠元素,F为氯元素。
⑴H在周期表中的位置为第一周期IA族;工业制备上Cl2的原理有电解饱和食盐水或电解熔融的NaCl,据此便可写出其相应的离子方程式。
⑵C、O、Na组成的一种盐中,满足E的质量分数为43%的盐为Na2CO3,俗称纯碱或苏打;其水溶液与Cl2反应,可理解为Cl2先与水反应有HCl和HClO,Na2CO3水解有NaHCO3和NaOH,二者再反应,可确定其生成物有NaClO、NaCl 、NaHCO3,然后通过氧化还原反应的配平方法将其配平;在产物中加入少量KI,NaClO将KI氧化生成I2,反应后加人CC14并振荡溶液显紫色。
⑶在这些元素中只有Na才与H形成二元离子化合物NaH(a的化学式);形成含有非极性共价键的二元离子化合物,且原子数之比为1:1的物质有Na2〇2和Na2C2(b的化学式);BDF2的化学式为COCl2,其结构式为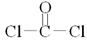 ,据此便可写出其电子式
,据此便可写出其电子式 ;只存在一种类型作用力且可导电的单质晶体为金属钠,属于金属晶体。
;只存在一种类型作用力且可导电的单质晶体为金属钠,属于金属晶体。
⑷由H和C、O元素组成的两种二元化合物CH4、H2O能形成一类新能源物质,一种化合物分子(H2O)通过氢键构成具有空腔的固体;另一种化合物(沼气的主要成分CH4)分子进入该空腔,CH4分子的空间结构为正四面体结构。
本题难度:一般
4、选择题 A和M为两种元素,已知A位于短周期,且A2-与M+的电子数之差为8,则下列说法正确的是(? )
A.A和M原子的电子总数之和可能为11
B.A和M的原子序数之差为8
C.A和M原子的最外层电子数之和为8
D.A和M原子的最外层电子数之差为7
参考答案:A
本题解析:A位于短周期,A2-可能为O2-或S2-,A2-与M+的电子数之差为8,可能为Na+或K+。
本题难度:简单
5、填空题 A、B、C、D分别代表四种不同的元素。A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍,D原子的L电子层的p轨道有3个电子。
(1)C原子的电子排布式为? ?,若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于? ?,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是? ?。
(2)当n=2时,B原子的结构示意图为? ?,B与C形成的晶体属于?晶体。当n=3时,B与C形成的晶体中,B原子的杂化方式为? ?,该晶体中最小的环共有? ?个微粒构成,微粒间的作用力是? ?。
(3)若A原子的最外层电子排布为4s1,B原子的价电排布为3s23p2,A在元素周期表中的位置是? ?,A、B、C、D四种元素的第一电离能由大到小的顺序是
? ?(用元素符号表示)。
B.(实验化学,12分)某化学研究性学习小组进行了一系列“带火星的木炭复燃”的实验,实验装置如下图所示。
(1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
编号
| I
| II
| III
| IV
| V
|
V(O2)/mL
| 60
| 40
| 20
| 12
| 10
|
V(空气)/mL
| 40
| 60
| 80
| 88
| 90
|
?现象
| 木炭复燃
| 木炭复燃
| 木炭复燃
| 木炭有时燃烧,有时不燃烧
| 木炭
不复燃
|
?
回答下列问题:
①使带火星木炭复燃的O2的体积分数最小约为? ?。
②用带火星木炭检验集气瓶里是否集满O2,若木炭复燃,能否认为集气瓶里的气体一定是纯净的O2?答:? ?(填“能”或“否”)。
③若按照3∶2的比例混合O2和CO2气体,该混合气体能否使带火星的木炭复燃?
答:? ?(“能”、“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
编号
| 制取气体A(下列反应产生的混合气体)
| B中的现象
| 结论
|
a
| 在烧瓶中加热适量浓HNO3
4HNO3?△?4NO2↑+O2↑+2H2O↑
| 充满红棕色气体,木炭不复燃,火星熄灭
| NO2不支持燃烧
|
b
| 加热AgNO3固体
2AgNO3?△?2NO2↑+O2↑+2Ag
| 充满红棕色气体,木炭复燃
| NO2支持燃烧
|
c
| 加热Cu(NO3)2固体
2Cu(NO3)2?△?4NO2↑+O2↑+2CuO
| 充满红棕色气体,木炭复燃
| NO2支持燃烧
|
?
你认为a、b、c三个结论是否可靠?说出你的理由。
a.? ?,原因是? ?。
b.? ?,原因是? ?。
c.? ?,原因是? ?。
参考答案:A(1)1s22s22p4(1分) σ(1分)?分子间形成氢键(1分)
(2) +6? 2 4 (1分)?分子(1分)? sp3(1分)? 12(2分)?共价键或极性共价键(1分)
(3)第4周期IA族(1分)? N>O>Si>K(2分)
B B.(1)①29.6% (2分)?②否 (2分) ③能(2分)
(2)a.不可靠(1分)?反应产生的水蒸气及从溶液中蒸发出来的水蒸可使木炭火星熄灭(1分)? b.不可靠(1分)?反应产生的气体中O2的体积分数为1/3,高于29.6%,木炭复燃可能是由于O2浓度增大所致(1分)? c.可靠(1分)?反应产生的气体中O2的体积分数为1/4,低于29.6%,如果NO2不支持燃烧,木炭就不会复燃。(1分)
本题解析:A(1)C元素最外层电子数为3的整数倍且不超过8,故最外层电子数为3或6。一个电子层最外层不能有3个电子,故只能是两个电子层最外层有6个电子,C是O元素。
(2)本题考查了二氧化碳、二氧化硅的结构。C、Si同主族,但其氧化物的结构却不相似 ,二氧化碳是分子晶体,二氧化硅是原子晶体。
(3)该题最外层电子排布为4s1的元素最常见是K,但不是唯一答案,还可以是Cr、Cu。
B? (1) ①第4组情况下,木条有时复燃有时不复燃就是燃烧极限。0.88×0.2+0.12=0.296。
③只要氧气体积分数达到0.296,就可以燃烧。
(2)a 组、c组中产生的二氧化氮和氧气体积比都是4:1,但一组支持复燃,一组不支持复燃,说明一定有其他因素导致了差别,再联系特别注明水为气体,可推测a 组结论不可靠因为忽略了水蒸气的存在 。b组、c组都支持燃烧,但二氧化氮和氧气体积比不相同,再联系前面所计算的氧气的燃烧极限的问题可知b组结论不可靠 ,氧气超过燃烧极限了,二氧化氮不助燃也一样能燃烧。该题的思路就是控制单一变量。
本题难度:一般