1、选择题 如图中,两电极上发生的电极反应如下:a极:Cu2++2e-=Cu;b极:Fe-2e-=Fe2+,则以下说法中不正确的是(?)
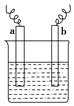
A.该装置一定是原电池
B.a极上一定发生还原反应
C.a、b可以是同种电极材料
D.该过程中能量的转换可以是电能转化为化学能
参考答案:A
本题解析:A项该装置不一定是原电池,可以是原电池也可以是电解池;B项根据已知条件,a极上发生Cu2++2e-=Cu反应,一定是还原反应;C项,a、b可以是同种电极材料,如用铁电极电解硫酸铜溶液;D项该过程中能量的转换可以是电能转化为化学能,也可以是化学能转化为电能。
本题难度:简单
2、选择题 如图所示,下列有关叙述正确的是
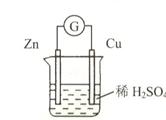
A.铜是负极,铜片上有气泡产生
B.铜片质量逐渐减少
C.锌是正极
D.氢离子被还原
参考答案:D
本题解析:该装置为铜锌原电池,铜为该电池的正极,锌片溶解,为电池的负极,A错误,铜是正极,铜片上有气泡产生;铜片质量并不发生变化,故B错误;锌是负极,故C错误,氢离子在铜极得到电子被还原,故D正确。
点评:本题考查了原电池的工作原理,该考点是高考考查的重点和难点,本题有利于考查学生对基础知识的掌握,该题难度不大。
本题难度:一般
3、填空题 (10分)甲醇合成反应为:CO(g)+2H2(g) 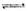 ?CH3OH(g)
?CH3OH(g)
工业上用天然气为原料,分为两阶段制备甲醇:
(1)制备合成气:CH4+H2O(g)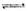 CO+3H2。为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO3+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为____________________________________。
CO+3H2。为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO3+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为____________________________________。
(2)合成甲醇:①反应过程 中物质能量变化如右图所示。写出合成甲醇的热化学方程式__________________。
中物质能量变化如右图所示。写出合成甲醇的热化学方程式__________________。

实验室在1L密闭容器中进行模拟合成实验。将lmolCO和2molH2通人容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:
(表中数据单位:mol·L—1)
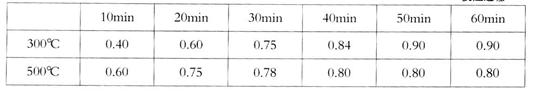 ②300℃时反应开始10分钟内,H2的平均反应速率为__________。
②300℃时反应开始10分钟内,H2的平均反应速率为__________。
③500℃时平衡常数K的数值为___________。
④300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系?产生的影响是__________(填字母)。
a.c(H2)减小? b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加? d.重新平衡时c(H2)/c(CH3OH)减小
参考答案:(1)3:1(2分)
(2)① ?
?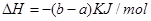 (2分)
(2分)
②0.080mol/(L·min)(2分)?③25(2分)?④c、d(全对2分,多选1个倒扣1分)
本题解析:略
本题难度:一般
4、选择题 用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①②
B.②③
C.②④
D.③④