1、选择题 关于右图所示的原电池,下列说法不正确的是?
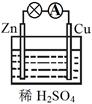 ?
?
A.Cu为正极,Zn为负极
B.该装置能将化学能转化为电能
C.电子由铜片通过导线流向锌片
D.正极反应为 2H+ + 2e- H2↑
H2↑
参考答案:C
本题解析:锌的金属性强于铜,所以锌是负极,失去电子。铜是正极,溶液中的氢离子得到电子生成氢气,所以正确的答案选C。
点评:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此可以进行有关的判断。
本题难度:一般
2、选择题 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是?(?)

实验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③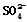 向Cu极移动 向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu―→Zn
⑥正极反应式:Cu—2e-===Cu2+,发生氧化反应
|
A.①②③? B.②③④? C.②④? D.③④⑤
参考答案:C
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。因此再Zn-Cu原电池中,Zn作负极,发生电池反应Zn+2H+=Zn2++H2↑,电子由负极流向正极,阳离子向正极移动。
Zn为负极,Cu为正极,故①错误;H+向正极移动,在铜电极上得到电子,放出氢气,故②正确;SO42-向负极锌电极移动,所以选项③错误;Cu电极上发生2H++2e-=H2↑,故⑥不正确;若有0.5mol电子流向导线,则产生氢气0.25mol,故④正确;电子由Zn电极流向Cu电极,故⑤不正确,答案选C。
点评:该题是高考种的常见题型和重要的考点,主要是考查学生对原电池原理、电极名称、电极反应式的了解掌握情况,旨在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确原电池的工作原理,电极的判断、发生的电极反应、电子、离子的移动方向,然后结合题意灵活运用即可。
本题难度:一般
3、选择题 LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4?负极 Li-e-="=" Li+下列说法中正确的是
A.充电时电池反应为FePO4+Li = LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电的正极相连
C.放电时电池内部Li+向负极移动
D.放电时,在正极上是Li+得电子被还原
参考答案:B
本题解析:A.放电时电池反应为FePO4+Li = LiFePO4。错误。B.在电池上标注的“+”、“-”就是充电时与外界电源的连接方式。因此动力电池上标注“+”的电极应与外接电的正极相连。正确。C.根据同种电荷相互排斥,异种电荷相互吸引的原则,在放电时电池内部Li+向负电荷较多的正极移动。错误。D.放电时,在正极上是FePO4中的+3价是Fe3+得电子被还原。错误。4新型锂离子动力电池在放电及充电时的反应原理的知识。
本题难度:一般
4、填空题 铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42-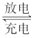 2PbSO4+2H2O 请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O 请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时,正极的电极反应式是________________;电解液中H2SO4的浓度将变________;当外电路通过1?mol电子时,理论上负极板的质量增加________g.
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成________,B电极上生成________,此时铅蓄电池的正负极的极性将________.
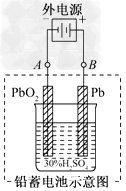
参考答案:(1)PbO2+2e-+4H++SO42-===PbSO4+2H2O;小;48
(2)Pb;PbO2;对换
本题解析:
本题难度:一般
5、选择题 镍—镉可充电电池可发生如下反应:Cd(OH)2+2Ni(OH)2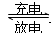 Cd+2NiO(OH)+2H2O,由此可知,该电池的负极材料是(?)
Cd+2NiO(OH)+2H2O,由此可知,该电池的负极材料是(?)
A.Cd
B.NiO(OH)
C.Cd(OH)2
D.Ni(OH)2
参考答案:A
本题解析:充电相当于电解池,放电相当于原电池。在原电池中较活泼的金属作负极,失去电子,发生氧化反应。所以根据反应式可知放电时Cd是还原剂,失去电子,作负极,因此答案选A。
本题难度:一般