1、选择题 某MCFC型燃料电池可同时供应电和水蒸汽,其工作温度为600℃~700℃,所用燃料为氢气,电解质为熔融的K2CO3。该电池的总反应为:2H2+O2=2H2O,负极电极反应式为: H2+CO32——2e— H2O+CO2。则下列判断中正确的是 (? )?
H2O+CO2。则下列判断中正确的是 (? )?
A.放电时CO32—向负极移动
B.放电时CO32—向正极移动
C.正极反应: 4OH——4e—=2H2O+O2↑
D.当电池中生成1 mol水时,转移4 mol电子
参考答案:A
本题解析:根据题意知,该燃料电池燃料为氢气,电解质为熔融的K2CO3,总反应为2H2+O2=2H2O,负极反应为H2+CO32——2e— H2O+CO2,正极反应式:O2+2CO2+4e-
H2O+CO2,正极反应式:O2+2CO2+4e- 2CO32-。A、放电时CO32—向负极移动,正确;B、放电时CO32—应向负极移动,错误;C、正极反应式为:O2+2CO2+4e-
2CO32-。A、放电时CO32—向负极移动,正确;B、放电时CO32—应向负极移动,错误;C、正极反应式为:O2+2CO2+4e- 2CO32-,错误;D、当电池中生成1 mol水时,转移2 mol电子,错误。
2CO32-,错误;D、当电池中生成1 mol水时,转移2 mol电子,错误。
本题难度:一般
2、填空题 (16分)(1)某课外活动小组同学用下图装置进行实验
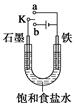
试回答下列问题:
①若开始时开关K与a连接,则铁发生电化学腐蚀中的 腐蚀。
②若开始时开关K与b连接,则总反应的离子方程式为 。
(2)芒硝化学式为Na2SO4·10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如下图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
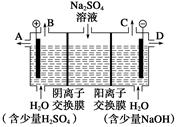
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”) 导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因: 。
④若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为 ,已知H2的燃烧热为285.8 kJ·mol-1,则该燃料电池工作产生36 g H2O时,理论上有 kJ的能量转化为电能。
参考答案:(16分)每空2分(1)①吸氧 ②2Cl-+2H2O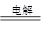 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(2)①4OH--4e-===2H2O+O2↑ 小于 ②D ③H+放电促进水的电离,使OH-浓度增大
④H2-2e-+2OH-==2H2O 571.6
本题解析:(1)①如果开关K与a连接,则构成原电池。NaCl溶液为中性,因此发生吸氧腐蚀,正极上氧气得电子发生还原反应;
②如果K与b连接,则构成电解池。铁与电源的负极相连,Fe作阴极,溶液中的氢离子放电。石墨作阳极,溶液中的氯离子放电,因此电解的总离子反应为2Cl-+2H2O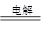 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(2)①电解时,阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,所以阳极上氢氧根离子失电子被氧化生成水和氧气,电极反应式为4OH--4e-=2H2O+O2↑;电解池中阴离子向阳极移动,阳离子向阴极移动,因此硫酸根离子向阳极移动,钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数;
②氢氧化钠在阴极生成,所以在D口导出;
③电解时阴极上氢离子放电生成氢气,氢离子来自于水的电离,所以促进水的电离,导致溶液中氢氧根离子的浓度大于氢离子的浓度,溶液的pH值增大;
④燃料原电池中,燃料在负极上失电子发生氧化反应,氧化剂在正极上得电子发生还原反应,该燃料原电池中,氧气是氧化剂,氢气是还原剂,氢氧化钠作为电解质,溶液显碱性,则负极电极反应式为H2-2e-+2OH-==2H2O;36g水的物质的量是36g÷18g/mol=2mol,消耗2mol氢气。由于H2的燃烧热为285.8 kJ·mol-1,则理论上有285.8 kJ·mol×2=571.6kJ的热量转化为电能。
考点:考查原电池和电解池原理
本题难度:困难
3、填空题 根据右图,回答下列问题:
(1)若闭合S1,装置属于______,锌极作______.
(2)若闭合S2,装置属于______,锌极上的反应为______.
(3)若闭合S3,装置属于______,总反应为______.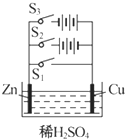
参考答案:(1)若闭合S1,符合原电池的构成条件:有活泼性不同的两个电极锌和铜,有电解质溶液硫酸,形成了闭合回路,其中活泼金属锌为负极,故答案为:原电池;负极;
(2)若闭合S2,则该装置是含有外加电源的装置,属于电解池,金属锌活泼金属作阳极,本身失电子,电极反应为:Zn-2e-═Zn2+,故答案为:电解池;Zn-2e-═Zn2+;
(3)若闭合S3,则该装置是含有外加电源的装置,属于电解池,金属锌做阴极,金属铜为阳极,电解的总反应为Cu+H2SO4 ?通电?.?CuSO4+H2↑,故答案为:Cu+H2SO4 ?通电?.?CuSO4+H2↑.
本题解析:
本题难度:简单
4、选择题 电子计算器所用的纽扣式电池为银锌电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-=Zn(OH)2、Ag2O+H2O+2e-=2Ag+2OH-。下列叙述中,不正确的是
[? ]
A.电子由锌经导线流向Ag2O
B.Zn是正极发生氧化反应;Ag2O是负极发生还原反应
C.Zn是负极,发生氧化反应;Ag2O是正极,发生还原反应
D.工作时,负极区域溶液的pH减小,正极区域溶液的pH增大
参考答案:B
本题解析:
本题难度:一般
5、选择题 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图。下列有关氢氧燃料电池的说法正确的是
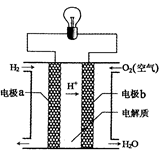
A.该电池的总反应:2H2+O2=2H2O
B.该电池中电极b是负极
C.外电路中电子由电极b通过导线流向电极a
D.该电池工作时电能转化为化学能