| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《原电池原理》高频考点强化练习(2019年最新版)(六)
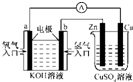 参考答案:A、右边装置是电解池,铜电极连接原电池的正极,所以铜电极是电解池的阳极,故A正确. 本题解析: 本题难度:简单 2、选择题 下列备装置中电流表有电流通过的是 参考答案:B 本题解析:A、电极均是Zn,不能形成电流,错误;B、Zn与硫酸铜溶液发生置换反应,且是闭合回路,所以可以形成原电池,有电流通过,正确;C、酒精是非电解质溶液,不能导电,所以没有电流通过,错误;D、未形成闭合回路,不能形成原电池,没有电流通过,错误,答案选B。 本题难度:一般 3、选择题 各烧杯中盛有海水,能形成原电池且铁为正极的是?(?) 参考答案:C 本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。A中只有1个电极,不能构成原电池,B中铁的金属性强于Sn的,铁是负极。C中锌的金属性强于铁的,铁是正极。D中铁的金属性强于铜的,铁是负极,答案选C。 本题难度:一般 4、选择题 原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( ) 参考答案:D 本题解析:A.由Al、Cu、稀H2SO4组成原电池,Al作负极,Cu作正极,根据同种电荷相互排斥,异种电荷相互吸引。所以放电时SO42-向正电荷较多的负极Al电极移动。正确。B.由Mg、Al、NaOH溶液组成原电池,Al作负极。其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O。正确。C.由Al、Cu、浓硝酸组成原电池,由于Al在浓硝酸中会发生钝化,所以Cu作负极,Al作正极。该原电池作电源,用石墨电极来电解硝酸银溶液,因为在整个闭合回路中电子转移数目相等。当析出1 mol Ag时,电子转移1mol,则消耗的Cu的质量为32 g。正确。D.由Fe、Cu、FeCl3溶液组成原电池,Fe活动性比Cu强,作负极,Cu作正极。其负极反应式为:Fe-2e-=Fe2+.错误。 本题难度:一般 5、填空题 (4分)(1)已知:一定量CH4完全燃烧生成CO2和液态水时,放出热量QkJ;若将燃烧产物全部通入过量的澄清石灰水,可得到20g沉淀,请写出CH4燃烧的热化学方程式 参考答案:(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H= -5QkJ/mol (2分) 本题解析:(1)20g沉淀是碳酸钙,物质的量是0.2mol,所以根据碳原子守恒可知燃烧生成的CO2也是0.2mol。所以生成1molCO2放出的热量是5QkJ,因此热化学方程式为 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《分子式、结.. | |