1、选择题 合成氨反应:N2(g)+3H2(g) 2NH3(g) △H= - 92.4 kJ/mol,在反应过程中,正反应速率的变化如下图
2NH3(g) △H= - 92.4 kJ/mol,在反应过程中,正反应速率的变化如下图
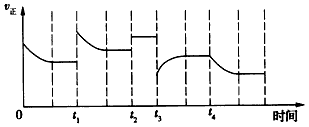
下列说法正确的是
[? ]
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
参考答案:B
本题解析:
本题难度:一般
2、填空题 (14分)Ⅰ.在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是 ;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
实验
混合溶液
| A
| B
| C
| D
| E
| F
|
4 mol·L-1H2SO4 / mL
| 30
| V1
| V2
| V3
| V4
| V5
|
饱和CuSO4溶液 / mL
| 0
| 0.5
| 2.5
| 5
| V6
| 20
|
H2O / mL
| V7
| V8
| V9
| 15
| 10
| 0
|
请完成此实验设计,其中:V2 V5 = , V6= ,V8= ;
(第一空填“>”、“<”或“=”;后三空填具体数值)
Ⅱ.常温下,某一元酸HA和NaOH溶液等体积混合,HA和NaOH的浓度以及混合后溶液的pH如下表:
组别
| c(HA)/mo1·L-1
| c(NaOH)/mo1·L-1
| 混合液pH
|
甲
| c
| 0.2
| pH = 7
|
乙
| 0.2
| 0.1
| pH>7
|
丙
| 0.1
| 0.1
| pH = 9
|
请回答下列问题:
(4)仅从甲组情况分析,c是否一定等于0.2 ? (选填“是”或“否”)。
(5)分析乙组实验数据,HA是 酸(选填“强”或“弱”)。该混合液中离子浓度由大到小的顺序是 。
(6)丙组所得混合液中由水电离出的c(OH-) = mo1·L-1。
参考答案:(14分)
 Ⅱ.(4)否(1分);
Ⅱ.(4)否(1分);
(5)弱(1分);c(Na+)>c(A-)>c(OH-)>c(H+)(或 [Na+]>[A-]>[OH-]>[H+])(2分)
(6)10-5 (2分);
本题解析:(1)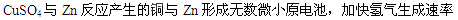
(2)加快化学反应的速率的因素有:升高温度、加入催化剂、增大压强(有气体参加的反应)、增大反应物的浓度、反应物的接触面积大小等,本题可采用的措施有:

(3)该实验的目的为:研究硫酸铜的量对氢气生成速率的影响,所以所取硫酸的量就是相同的,即V2=V5 =30;
由所加饱和CuSO4溶液的数据分析可得:V6=10;比较D、E、F中饱和CuSO4溶液的体积与所加水的体积分析可知,饱和CuSO4溶液的体积与加入水的体积和为20,进而求得V8=19.5;
(4)对于甲组来说,溶液的pH = 7为中性溶液,但无法确定c是否一定等于0.2,HA可以为弱酸,也可以为强酸;
(5)由乙组数pH>7,溶液呈碱性,且在等体积混合的情况下,HA的浓度又是NaOH溶液的2倍,即可得HA一定为弱酸。该混合体系中,溶液中的溶质为等物质的量的HA、NaA,
溶液中的离子成分为:Na+、A-、H+、OH-四种成分,由于溶液呈碱性,即以A-水解为主HA电离为次,所以溶液中各离子浓度的大小关系为:c(Na+)>c(A-)>c(OH-)>c(H+)
(6)丙组为等体积等物质的量浓度的一元酸与一元碱混合,混合后溶液中的溶质为NaA,因溶液的pH = 9,即HA为弱酸,A-水解使溶液呈碱性,促进水的电离。水电离出的c(OH-) =10-5
本题难度:简单
3、选择题 将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是?
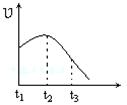
A.从t1→t2的主要原因是镁与酸的反应是放热反应,体系温度升高
B.从t1→t2的主要原因是镁与水反应,致使酸的浓度升高
C.从t2→t3的主要原因是随着反应的进行镁体积减少
D.从t2→t3的主要原因是随着反应的进行温度越来越低
参考答案:A
本题解析:应用镁和盐酸的反应是放热反应,随着温度的升高,反应速率逐渐增大,A正确。但随着反应的进行,氢离子的浓度逐渐减小,所以反应速率又逐渐降低下来,因此BCD都是错误的,答案选A。
本题难度:一般
4、填空题 等物质的量A、B、C、D四种物质混合,发生如下反应:
aA(?)+bB(?)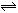 cC(固)+dD(?)
cC(固)+dD(?)
当反应进行到一定时间后,测得A减少n mol,B减少 ,C增加
,C增加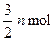 ,
,
D增加n mol,此时达到化学平衡状态.
(1)该化学方程式中各系数为a=________,b=________,c=________,d=________.
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,则该反应中各物质的聚集状态是:A_________,B_________,D_________.
(3)若只升高温度,反应一段时间后,测知四种物质的量又达到相等,则该反应是________反应(填“放热”或“吸热”
参考答案:(1)2? 1? 3? 2
(2)气?固或液?气
(3)放热
本题解析:略
本题难度:简单
5、选择题 设C+CO2  2CO(正反应为吸热反应),反应速率为υ1;N2+3H2
2CO(正反应为吸热反应),反应速率为υ1;N2+3H2 2NH3(正反应为放热反应),反应速率为υ2,对于上述反应,当温度升高时,υ1和υ2的变化情况为
2NH3(正反应为放热反应),反应速率为υ2,对于上述反应,当温度升高时,υ1和υ2的变化情况为
A.同时增大
B.同时减小
C.υ1增大,υ2减小
D.υ1减小,υ2增大
参考答案:A
本题解析:只要升高温度,反应速率一定增大,与反应是放热反应,还是吸热反应无关系,因此正确的答案选A。
本题难度:一般