1、选择题 下列有关化学反应现象和化学原理的解释正确的是
[? ]
现象或反应
原理解释
A.
KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去
SO2具有漂白性
B.
合成氨反应需在高温条件下进行
该反应为吸热反应
C.
蒸馏时,温度计的水银球应靠近蒸馏烧瓶支管口处
在此位置指示被蒸馏
物质的沸点才更加准确
D.
SO2=S+O2在任何条件下均不能自发进行
该反应△H>0,△S>0
参考答案:D
本题解析:
本题难度:一般
2、选择题 100ml?1mol/L的盐酸跟过量锌片反应,为加快反应速率.又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的2mol/L的盐酸
B.加入数滴CuSO4溶液
C.加入适量的蒸馏水
D.将反应装置放入冰水中冷却
参考答案:A、加入适量的2mol/L的盐酸,氢离子浓度增大和物质的量增大,加快反应速率,但是影响生成氢气的总量,故A错误;
B、加入数滴CuSO4溶液,Zn与硫酸铜反应置换出铜,形成原电池,反应速率加快,在Zn过量时,不会影响生成的氢气总量,故B正确;
C、加入适量的蒸馏水,相当于把盐酸稀释,反应速率减慢,生成氢气的量不变,故C错误;
D、将反应装置放入冰水中冷却相当于降温,反应速率减慢,故D错误.
故选B.
本题解析:
本题难度:一般
3、填空题 智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。
(1)试配平该反应的化学方程式,并用短线标出电子转移方向及总数。
(2)?
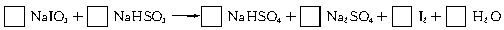
(2)已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备实验时,定时取样,并用酸化的氯化钡来检测SO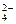 生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因:?。
生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因:?。
参考答案:(1)2? 5? ="==?" 3? 2? 1? 1? (说明:错一个即不给分)

(2)开始阶段由于HSO 被氧化生成H+和SO
被氧化生成H+和SO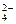 ,酸性加强,反应速度增大
,酸性加强,反应速度增大
本题解析:(1)考查氧化还原方程式的配平;(2)考查影响化学反应速率的外界条件。
由题意,速率加快的原因不可能是:①压强增大;②温度升高;③催化剂的使用;④反应物HSO 、IO
、IO 浓度增大。只能是由于5HSO
浓度增大。只能是由于5HSO +2IO
+2IO ===5SO
===5SO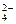 +I2+3H++H2O反应的发生,使得c(H+)浓度增大,酸性增强,反应速率加快(题给信息)。
+I2+3H++H2O反应的发生,使得c(H+)浓度增大,酸性增强,反应速率加快(题给信息)。
本题难度:一般
4、选择题 下列溶液与Fe反应制取H2的速率最快的是?
A.20mL 、1.0 mol·L-1盐酸
B.5mL 、1.0 mol·L-1 H2SO4
C.10mL 、18.4 mol·L-1 H2SO4
D.20mL 、3.0 mol·L-1 HNO3
参考答案:B
本题解析:考查外界条件对反应速率的影响。在其它条件不变时,增大反应物浓度,或升高温度,或增大压强(有气体参加的反应),海鸥增大反应物的接触面积,或使用催化剂等等能使反应速率加快,B中氢离子浓度增大,反应速率最快,B正确。C发生钝化,得不到氢气,D中生成的NO气体,所以正确的答案选B。
本题难度:简单
5、选择题 某温度下,对可逆反应2X(g) + Y(g)  3Z(g) + W(s)? ΔH>0 的叙述正确的是
3Z(g) + W(s)? ΔH>0 的叙述正确的是
A.加入少量W,逆反应速率增大,平衡向左移动
B.增大压强,正反应速率增大,逆反应速率减小
C.温度、体积不变,充入He气增大压强,反应速率会加快
D.升高温度,混合气体的平均相对分子质量减小
参考答案:D
本题解析:A、W是固体,增大固体的用量,平衡不移动,错误;B、该反应是反应前后气体的物质的量不改变的可逆反应,所以压强的改变对平衡无影响,正逆反应的速率增大相同的倍数,错误;C、温度、体积不变,充入He气增大压强,但反应体系中的各物质的浓度不变,反应速率不变,错误;D、升高温度,平衡会正向移动,而正向是气体的质量减小的方向,气体的总物质的量不变,所以混合气体的平均相对分子质量减小,正确,答案选D。
本题难度:一般