1、填空题 (12分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:
物质
| VOSO4
| V2O5
| NH4VO3
| (VO2)2SO4
|
溶解性
| 可溶
| 难溶
| 难溶
| 易溶
|
该工艺的主要流程如下。
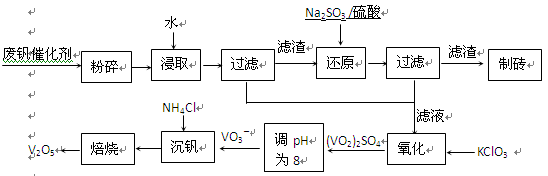
请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式??。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如下左图)。其中a、c二步的化学方程式可表示为
?,??。
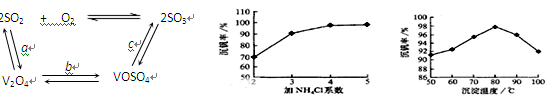
(3)该工艺中沉矾率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据上右图试建议控制氯化铵系数和温度:?、?。
(4)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如右图所示。则NH4VO3在分解过程中???。

A.先分解失去H2O,再分解失去NH3?
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3?
D.同时分解失去H2、N2和H2O
参考答案:(1)V2O5+ SO32—+4H+=2VO2++SO42—+2H2O
(2)SO2+V2O5 SO3+ V2O4? 4VOSO4+O2
SO3+ V2O4? 4VOSO4+O2 2V2O5+4SO3
2V2O5+4SO3
(3)4和80℃?(4)? B
本题解析:略
本题难度:一般
2、选择题 化学与生产、生活、科技等密切相关。下列说法正确的是
A.煤经气化和液化两个物理变化过程,可变为清洁能源
B.国务院要求坚决控制钢铁水泥焦炭等行业产能总量是落实“低碳经济”的具体举措
C.苯酚稀溶液常用于外科消毒,所以自来水也可以用苯酚进行消毒处理
D.“神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃
参考答案:B
本题解析:煤的气化和液化都是化学变化,A不正确;苯酚有毒,自来水不能用苯酚消毒,C不正确;聚四氟乙烯属于是高分子化合物,不存在碳碳双键,D不正确,答案选B。
点评:该题是基础性试题的考查,试题注重基础,难度不大。该类试题常把化学知识与实际生产、生活、环境保护及科技前沿等问题结合起来,突出化学与可持续发展、环境保护的密切联系,综合考查学生分析问题、解决问题的能力。
本题难度:一般
3、填空题 阿司匹林(乙酰水杨酸)是由水杨酸和乙酸酐合成的:

在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150 mL干燥锥形瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85~90 ℃条件下反应5~10 min,然后冷却,即有乙酰水杨酸晶体析出。
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL饱和碳酸氢钠溶液,加完后继续搅拌2~3 min,直到没有二氧化碳气体产生为止。过滤,用5~10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4 mol·L-1盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1~2次,再抽干水分,即得产品。
(1)第①步中,要控制温度在85~90℃,应采用的加热方法是____________,用这种方法加热需要的玻璃仪器有________。
(2)在第②步中,用冷水洗涤晶体,其目的是____________、____________。
(3)在第③步中,加入饱和碳酸氢钠溶液的作用是________________,加入盐酸的作用是____________。
(4)如何检验产品中是否混有水杨酸?____________。
参考答案:(1)水浴加热 温度计、酒精灯、烧杯
(2)除去晶体表面附着的可溶性杂质 减少阿司匹林的溶解
(3)使阿司匹林转化为可溶性盐 将阿司匹林的可溶性盐重新转化为阿司匹林
(4)向水中加入少量产品,滴加氯化铁溶液,若有紫色出现,说明产品中含有水杨酸
本题解析:本题考查物质的制备,难度中等。(1)水浴加热可以控制温度在100 ℃以下,加热面积大,受热稳定。
(2)用冷水洗涤晶体可以除去晶体表面附着的可溶性杂质,减少阿司匹林的溶解。
(3)阿司匹林分子中有羧基,酸性比碳酸酸性强,比盐酸酸性弱,能与碳酸氢钠反应生成可溶性盐;加入盐酸可将阿司匹林的可溶性盐重新转化为阿司匹林。
(4)水杨酸分子中含有酚羟基,能与氯化铁溶液发生显色反应。
本题难度:简单
4、填空题 (12分)、高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
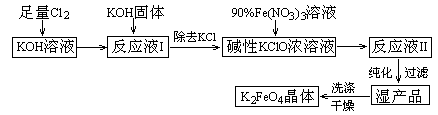
已知:①? 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
②? 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③? 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
⑴该生产工艺应在?__?(填“温度较高”或“温度较低”)的情况下进行;
⑵写出工业上制取Cl2的化学方程式?__?;
⑶配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为?__?;
⑷在“反应液I”中加KOH固体的目的是?__?:
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO