1、填空题 (6分)热重分析法是程序控制温度下,测量物质的质量与温度的关系的一种实验技术。现有一CaC2O4·nH2O试样,分别在氮气气氛、氧气气氛中进行热重分析,得到如下热重(TG)曲线。
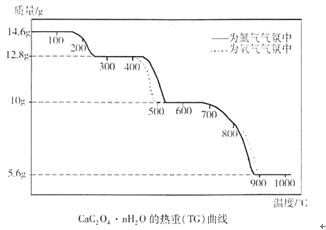
(1)图中曲线上有三个失重台阶,分别表示加热过程中依次发生了三个反应。根据第1步反应的失重数据计算试样CaC2O4·nH2O中的n值(精确到整数)为?。
(2)根据第2步反应的失重数据推测第2反应的化学方程式为?;观察曲线说明氧气存在时有利于第2步反应进行,原因是?。
(3)第3步反应中释放的气体产物是?。观察曲线可判断出,氧气存在时不利于第3步反应进行,可能原因是?。
参考答案:

本题解析:略
本题难度:简单
2、选择题 2010年上海世博会的主题是“城市,让生活更美好”。下列叙述中不正确的是
A.世博会前期,处理废水时加入明矾可作为混凝剂以吸附水中的杂质
B.把世博会期间产生的垃圾焚烧或深埋处理
C.某些馆的外壳使用非晶硅薄膜,以充分利用太阳能
D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体
参考答案:B
本题解析:垃圾应该分类回收、废物利用,简单的焚烧或深埋会产生新的污染物或治标不治本,故答案为B
本题难度:一般
3、选择题 化学作为一门自然科学倾注着无数科学家的心血和智慧。下列科学家与做出的贡献不一致的是
A.凯库勒——苯的发现和提出苯分子结构学说
B.科里——提出有机合成逆合成分析原理
C.门捷列夫——由无机物合成有机物,打破了有机物的生命力学说
D.阿伏加德罗——提出原子—分子学说
参考答案:C
本题解析:
答案:C
门捷列夫——德米特里·门捷列夫,19世纪俄国化学家,他发现了元素周期律,并就此发表了世界上第一份元素周期表。
弗里德里希·维勒,德国化学家。他因人工合成了尿素,打破了有机化合物的“生命力”学说而闻名。
本题难度:简单
4、选择题 化学是研究物质的结构、性质、制备及应用的一门科学,研究的物质必须是(? )
A.单质
B.化合物
C.纯净物
D.混合物
参考答案:C
本题解析:
正确答案:C
只有纯净物才有固定的性质,重复实验时,才能得到相同的结论。
A和B叙述不全面;D、组成不同,性质不同。
本题难度:简单
5、填空题 以合成氨工厂工艺流程如下图,试回答相关问题:
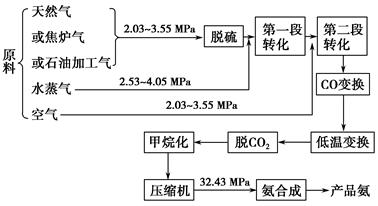
(1)不同的原料生产氢气其经济指标如下表:
?
| 天然气
| 石脑油
| 重油
| 煤焦
|
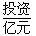
| 5.6
| 6.5
| 8.0
| -
|
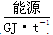
| 28~30
| 35.5
| 41.8
| 54.4
|
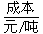
| 257
| 390~447
| 220~280
| 500
|
?
从上表数据及自然资源来看最具发展前景的是________。
A.天然气?B.石脑油?C.重油 ?D.煤焦
(2)脱硫工艺一般是通过金属氧化物来实现的,通过三步反应最后再生成金属氧化物,并得到单质硫,请补充第三步反应。
①MezOy+zH2S+(y-z)H2=MezSz+yH2O
②MezSz+ O2=MezOy+zSO2
O2=MezOy+zSO2
③__________________________________________________
(3)气体的精制 经净化过的气体仍有少量的CO等有害气体。常用的方法有铜洗法和甲烷化法。CO(g)+Cu(NH3)2Ac+NH3(l)?[Cu(NH3)3CO]Ac;正反应放热,反应在铜洗塔中进行,吸收后的铜液送到再生器中,在再生器处解吸CO,适宜条件是________,解吸后铜液循环使用。甲烷化法则是把CO、CO2转化为对氨合成无害的CH4,主要反应是CO(g)+3H2(g) CH4(g)+H2O(g);正反应放热,甲烷化的条件是__________________。
CH4(g)+H2O(g);正反应放热,甲烷化的条件是__________________。
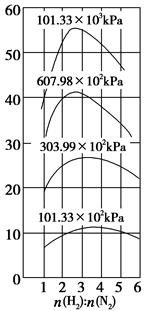
(4)500 ℃时,y随 及压强的变化关系。纵坐标可能是____________,结合目前生产的条件,应控制的
及压强的变化关系。纵坐标可能是____________,结合目前生产的条件,应控制的 是________。
是________。
参考答案:(1)A
(2)MezSz+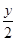 SO2=MezOy+
SO2=MezOy+ S
S
(3)减压和加热 高压、适当温度
(4)平衡时混合气体中氨气的体积分数 略小于3∶1
本题解析:本题考查了平衡原理在工业生产中的应用。(1)发展前景一方面从成本比较,另一方面还要比较能量消耗,综合两者天然气更具前景。(2)补充方程式的关键是理解题意,最后生成金属氧化物和硫单质。反应②中生成SO2,要将SO2转化成硫单质。金属硫化物中硫显-2价,SO2中硫显+4价,通过两者归中反应可制得硫。(3)将CO解吸出来,要使平衡向逆反应方向移动,甲烷化的条件是平衡正向移动,高压和适宜温度。(4)压强增大,平衡向正反应方向移动,观察图像,y也增大;提高H2的比例,y先增大后减小,y可能是平衡时混合气体中氨气的体积分数。观察图像可知,当 略小于3∶1时,氨气的体积分数在相同条件下最大。
略小于3∶1时,氨气的体积分数在相同条件下最大。
本题难度:一般