1、选择题 实验室中,要使AlCl3溶液中的Al3+全部沉淀出来,适宜用的试剂是
[? ]
A.NaOH溶液?
B.Ba(OH)2溶液
C.盐酸?
D.氨水
参考答案:D
本题解析:
本题难度:简单
2、选择题 某无色溶液中,已知含有H+、Al3+、Mg2+等阳离子,逐渐加入NaOH溶液,则消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系可用下图来表示,则下列关系正确的是(?)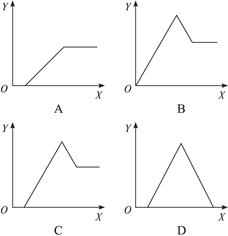
参考答案:C
本题解析:无色溶液中加入氢氧化钠溶液时,OH-首先与H+反应,无沉淀生成,然后再与Al3+、Mg2+作用形成沉淀,沉淀处于最高点时Al3+、Mg2+全部以氢氧化物析出,继续加碱时,由于氢氧化铝具有两性会继续溶解,而氢氧化镁不能溶解,故A、B、D三项均不正确。
本题难度:简单
3、选择题 有一块Al-Fe合金,溶于足量的盐酸中,再用过量的NaOH溶液处理,将产生的沉淀过滤、洗涤、干燥、灼烧完全变成红色粉末后,经称量,红色粉末的质量恰好与合金的质量相等,则合金中铝的质量分数为(?)
A.70%
B.30%
C.47.6%
D.52.4%
参考答案:B
本题解析:略
本题难度:简单
4、选择题 下列实验操作能达到预期实验目的的是
?
| 实验目的
| 实验操作
|
A
| 鉴别Al3+和Fe3+
| 分别加入过量NaOH溶液
|
B
| 比较Fe和Cu的金属活动性
| 分别加入浓硝酸
|
C
| 证明品红溶液褪色的原因是通入了SO2
| 将褪色后的溶液再加热
|
D
| 分离乙酸乙酯和乙酸
| 加饱和NaOH溶液,蒸馏
参考答案:AC
本题解析:A.氢氧化铝溶于过量的氢氧化钠溶液,而氢氧化铁不溶,正确;B.铁在浓硝酸中会发生钝化现象,而铜会与浓硝酸反应,应该选用稀硫酸才合理,错误;C.二氧化硫使品红褪色的原理是生成了无色不稳定的物质,当受热后又会分解,恢复原来的颜色,正确;D.乙酸乙酯在氢氧化钠溶液中会水解,联系课本实验乙酸乙酯的制备可知,当选用饱和的碳酸钠溶液,错误。
本题难度:一般
5、填空题 (9分) 铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
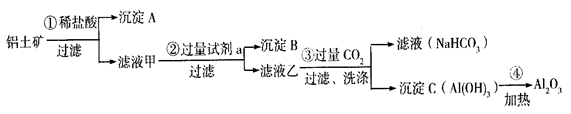
① 沉淀  A、B的成分分别是?、?;步骤②?中的试剂a是?; A、B的成分分别是?、?;步骤②?中的试剂a是?;
② 试写出步骤③中发生反应的离子方式?__________?、
?__________?__________?;
③简述检验所得滤液甲 中存在Fe3+的操作方法:__________?_。 中存在Fe3+的操作方法:__________?_。
参考答案:(1)?① SiO2? Fe(OH)3? NaOH溶液(各1分)

本题解析:略
本题难度:一般
|