1、填空题 某同学欲检验抗酸药中是否含有Al(OH)3,操作如下:取药剂3-4片研碎,向样品中加入过量的盐酸,过滤,得澄清溶液,向澄清溶液中滴加NaOH溶液,观察到有白色沉淀,继续加过量NaOH溶液,白色沉淀又溶解。你能得出该抗酸药中是否含有Al(OH)3____(填“含”或“不含”),请写出有关反应的化学方程式:①Al(OH)3+3HCl=AlCl3+3H2O;②________________;③________________。
参考答案:含;②AlCl3+3NaOH=Al(OH)3↓+3NaCl;③Al(OH)3+NaOH=NaAlO2+2H2O
本题解析:
本题难度:一般
2、选择题 下列元素在一定条件下能实现“单质
氧化物氧化物酸”直接转化的是( )
A.硅
B.硫
C.铁
D.铝
参考答案:A.硅不是变价元素,故A错误;
B.硫是变价元素,硫被氧气氧化生成二氧化硫,在一定条件下,二氧化硫能被氧气氧化生成三氧化硫,三氧化硫是酸性氧化物,所以能和水反应生成酸,故B正确;
C.铁是变价金属元素,但铁的氧化物不和水反应,故C错误;
D.铝不是变价元素,故D错误;
故选B.
本题解析:
本题难度:一般
3、推断题 (12分)A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
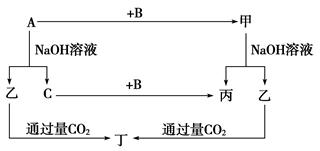
根据图示转化关系回答:
(1)写出下列物质的化学式。
A________________,B________________,
乙________________,丁________________。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式_______________________
____________________________________________________________________。
②甲与NaOH溶液反应的离子方程式_______________________
____________________________________________________________________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子的物质的量为________。
参考答案:(1)Al O2 NaAlO2 Al(OH)3
(2)①2Al+2NaOH+2H2O===2NaAlO2+3H2↑ ?②Al2O3+2OH-===2AlO2-+H2O?
(3)0.1 mol 0.3 mol
本题解析:根据图示可知A为Al,C为H2,乙为NaAlO2,丁为Al(OH)3,B为O2,甲为Al2O3,丙为H2O。
Al与NaOH溶液反应为2Al+2NaOH+2H2O===2NaAlO2+3H2↑,产生3.36L氢气需要0.1mol的Al,1molAl在反应中转移3mol电子,所以转移的电子数为0.3mol。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合.它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法.。解框图题的方法:最关键的是寻找"突破口"!,"突破口"就是抓"特"字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
4、选择题 等物质的量的Fe,Mg,Al分别与足量的物质的量浓度相同的盐酸完全反应,消耗盐酸的体积比为( )
A.2:3:1
B.2:2:3
C.3:2:1
D.1:3:2
参考答案:Fe,Mg,Al分别与盐酸反应的方程式为:
Fe+2HCl═H2↑+FeCl2,
Mg+2HCl=MgCl2+H2↑,
Al+3HCl═32H2↑+AlCl3,
设铁、镁、铝的物质的量分别为1mol,根据反应式可知消耗的盐酸的物质的量分别为:2mol,2mol,3mol,
消耗盐酸的物质的量之比为:2:2:3,消耗等浓度盐酸的体积之比也为2:2:3.
故选B.
本题解析:
本题难度:一般
5、选择题 向20 mL 1 mol/L的Al2(SO4)3溶液中加入30 mL KOH溶液充分反应后得到0.78 g沉淀,则KOH溶液的物质的量浓度为( )
A.1 mol/L
B.3 mol/L
C.5 mol/L
D.7 mol/L
参考答案:AC
本题解析:略
本题难度:简单