1、推断题 核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q,其中:在同周期元素中,Z的金属性最强,Q的非金属性最强;W的单质是自然界存在的黄色固体;X、Y、W在周期表中的相对位置关系如图所示

(1)五种元素形成的单质中常用作强氧化剂的是________、________(填化学式)
(2)这五种元素中,原子半径最大的是________(填化学式);由Z、W、Q形成的简单离子半径由大到小的顺序是________(用化学式表示);X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序为________(用化学式表示)。
(3)Y和Z形成的一种化合物中含有离子键和共价键,写出该化合物与水反应的化学方程式________________________。
(4)Z与Q反应生成的化合物属于________化合物;电解该化合物的饱和溶液,阳极的电极反应式为________________;电解一段时间后,将阳极产物和阴极溶液混合,反应的化学方程式是________________。
(5)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9 g该化合物燃烧生成XY2和液态H2Y时。放出
140 kJ的热量。写出该化合物燃烧热的热化学方程式:________________________。
参考答案:(1)O2(或O3);Cl2
(2)Na;S2->Cl->Na+;HClO4>H2SO4>H2CO3
(3)2Na2O2+2H2O==4NaOH+O2↑
(4)离子;2Cl--2e-==Cl2↑;Cl2+2NaOH==NaCl+NaClO+H2O
(5)C6H12O6(s)+6O2(g)==6CO2(g)+6H2O(1) △H= -2800kJ/mol
本题解析:
本题难度:一般
2、简答题 如表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
?主族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族
2
①
②
③
3
④
⑤
⑥
⑦
⑧
|
(1)在这些元素中,(用元素符号填写,下同)最活泼的金属元素是______; 最活泼的非金属元素是______;最不活泼的元素是______.
(2)这些元素的最高价氧化物的对应水化物中,酸性最强的化合物的分子式是______;碱性最强的化合物的电子式是______;能形成两性氢氧化物的元素是______.
(3)②的氢化物分子式为______,属于______化合物(填“共价”或“离子”);
(4)⑥的元素符号为______,原子结构示意图为______
(5)①和⑦形成的化合物的电子式为______.
参考答案:根据周期表中短周期元素的分布知识,可知:①为C②为N③为O④为Na⑤为Al⑥为S⑦为Cl⑧为Ar.
(1)周期表中从左到右,元素的金属性逐渐减弱,金属活泼性减弱,同主族,从上到下,元素的金属性逐渐增强,金属活泼性增强,所以最活泼的金属元素是Na,最活泼的非金属元素是Cl,最不活泼的元素是Ne,故答案为:Na;Cl;Ne;
(2)周期表中,同周期从左到右,元素的最高价氧化物的对应水化物的酸性逐渐增强,碱性逐渐减弱,同主族,从下到上,元素的最高价氧化物的对应水化物的酸性逐渐增强,碱性逐渐减弱,所以这些元素的最高价氧化物的对应水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的是NaOH,是含有离子键和共价键的离子化合物,电子式为:

,氢氧化铝具有两性,故答案为:HClO4;

;Al;
(3)氨气中的氢原子和氧原子间是共价键,属于共价化合物,故答案为:NH3;共价;
(4)根据原子结构示意图,硫原子核内质子数为16,核外电子数是16,结构示意图为:
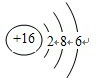
,故答案为:S;
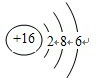
;
(5)碳和氯形成的化合物四氯化碳是含有共价键的极性分子,碳和氯均达到了8电子稳定结构.电子式为:

,故答案为:

.
本题解析:
本题难度:一般
3、选择题 在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是( )
A.制催化剂的材料
B.耐高温、耐腐蚀的合金材料
C.制农药的材料
D.半导体材料
参考答案:A.可以用于做催化剂的元素种类较多,一般为过渡金属元素,故A错误;
B.耐高温、耐腐蚀的合金材料为金属材料,一般具有较强的金属性,大多属于过渡金属元素,故B错误;
C.非金属元素位于右上方,非金属可以制备有机溶剂,部分有机溶剂可以用来做农药,故C错误;
D.在金属元素和非金属元素交接区域的元素通常既具有金属性又具有非金属性,可以用来做良好的半导体材料,如硅等,故D正确.
故选D.
本题解析:
本题难度:简单
4、推断题 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物。 ?
(1)W在元素周期表中的位置是_____________。
(2)?2.24?L(标准状况)XQ3被200?mL?1?moL/L?QXY3,溶液吸收后,所得溶液中离子浓度从大到小的顺序是___________________。
(3)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是______________________。
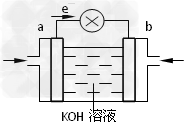
(4)已知:
W(s)+Y2(g)=WY2(g)? △H=?-393.5?kJ/mol ?
WY(g)+1/2Y2(g)=WY2(g)?△H=?-283.0?kJ/mol ?
24g?W与一定量的Y2反应,放出热量362.5?kJ,所得产物的物质的量之比是__________。
(5)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是____________________________。
参考答案:(1)第二周期第ⅣA族?
(2)c(NO3-)>?c(H+)?>c(NH4+)>?c(OH-)
(3)CH3OH-6e-?+?8OH-?==?CO32-?+?6H2O
(4)n(CO2):n(CO)=1:3
(5)Na3N?+?4H2O?==?3NaOH?+?NH3·H2O
本题解析:
本题难度:一般
5、选择题 下表符号中“2”的含义正确的一组是( )
| 12H | 2He | 2Cl | Ca2+
A
质量数
中子数
质子数
电荷数
B
质量数
质子数
原子个数
电荷数
C
质子数
中子数
原子个数
电荷数
D
质量数
质子数
中子数
电荷数
|
A.A
B.B
C.C
D.D
参考答案:12H中的2代表质量数,2He中的2代表质子数,2Cl中的2代表原子的个数,Ca2+中的2代表电荷数.
故选B.
本题解析:
本题难度:简单