1、填空题 (8分)恒容体系,发生如下反应2A(g)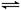 B(g)+xC(g) ΔH,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图。某课外活动小组一共进行了如图所示的三个实验(其中T1、T2表示不同的反应温度)。
B(g)+xC(g) ΔH,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图。某课外活动小组一共进行了如图所示的三个实验(其中T1、T2表示不同的反应温度)。
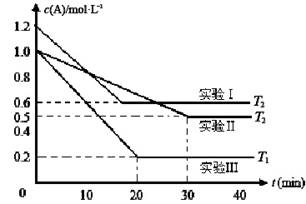
(1)在实验Ⅲ中,0~20min的时间内,v(A)= 。
(2)分析实验I和实验II的数据,可知x= ;分析实验II和实验Ⅲ的数据,可知反应热ΔH 0(选填“>”、“=”或者“<”)。
(3)能说明该反应达到平衡状态的是(选填代号字母) 。
a.A的质量不再变化
b.混合气体的密度保持不变
c.用A、B、C表示的反应速率的比为2∶1∶x
d.单位时间内生成n mol B的同时生成2n mol A
e.混合气体的平均摩尔质量保持不变
(4)T1℃时,保持容器的体积不变,若充入a mol A、b mol B、c mol C,达到平衡时C的体积分数为0.4,则a、b、c应满足什么条件 。
参考答案:(8分)(1)0.04 mol/(L·min)(2分);(2)1(1分); >(1分);(3)ad(2分,漏选得1分,错选不给分);
(4)b=c,a为大于0的任意值(或a∶b∶c=x∶1∶1,x为大于零的任意值)(2分,只要有b=c即可得2分);
本题解析:(1)在实验Ⅲ中,0~20min的时间内,v(A)=(1.0mol/L-0.2mol/L)÷20min=0.04 mol/(L·min);(2)分析实验I和实验II的数据,可知反应温度相同,而实验I反应物A的浓度大,反应速率快,首先达到平衡,无论反应快慢,达到平衡时。c(A)总是原来的一半,说明增大压强,平衡不发生移动,则该反应是反应前后气体体积相等的反应。所以x=1;通过观察实验II和实验Ⅲ的图像,可知二者的起始浓度相等,实验Ⅲ先达到平衡,说明温度T1>T2,根据平衡移动原理,升高温度,平衡向吸热反应方向移动,由于温度高时c(A)减少,说明升高温度,平衡正向移动,正反应方向为吸热反应,所以可知反应热ΔH>0;(3)a.当反应达到平衡时,任何一支物质的物质的量不变,物质的质量不变,因此A的质量不再变化,则反应达到平衡状态,正确;b.由于反应是在恒容体系中进行,所有物质都是气体,所以无论反应进行到任何程度,混合气体的密度保持不变,因此不能判断反应是否处于平衡状态,错误;c.由于A、B、C三种物质的系数比为2:1:x,所以在任何时刻都存在用A、B、C表示的反应速率的比为2∶1∶x,故不能判断反应是否处于平衡状态,正确;d.单位时间内生成n mol B,就会消耗2nmol的A,同时生成2n mol A,则A的物质的量不变,反应处于平衡状态,正确;e.由于反应是等体积的反应,所以在任何时刻气体的密度不变,混合气体的平均摩尔质量也就保持不变,因此不能判断反应是否处于平衡状态,错误。正确的选项是ad。(4)对于实验Ⅲ,反应开始是c(A)=1.0mol/L,当反应达到平衡时,由于c(A)=0.2mol/L,则根据方程式中各种物质的关系可知:c(B)=c(C)=0.4mol/L,C的体积分数为0.4。由于在T1℃时,当反应处于平衡状态时,保持容器的体积不变,若充入a mol A、b mol B、c mol C,达到平衡时C的体积分数为0.4,则反应为等效平衡,将生成物B、C一边倒转化,若与原反应的物质的量的比相同,则平衡等效.所以a、b、c应满足的条件是b=c,a为大于0的任意值;
考点:考查化学反应速率的计算、物质化学反应方程式的系数的确定、反应热的判断、化学平衡状态的判断、等效平衡的条件的确定的知识。
本题难度:一般
2、选择题 I2在KI溶液中存在下列平衡:I2(aq) +I- (aq)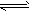 I3-(aq) 某I2、KI混合溶液中,I3-的物质的量浓度与温度T的关系如图所示(曲线上任何一点均表示平衡状态),下列说法正确的是
I3-(aq) 某I2、KI混合溶液中,I3-的物质的量浓度与温度T的关系如图所示(曲线上任何一点均表示平衡状态),下列说法正确的是
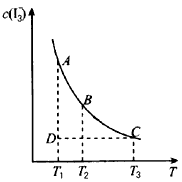
[? ]
A.状态A与状态B相比,状态A的c(I2)大于状态B的c(I2)
B.若温度T1,T2的平衡常数分别为K1,K2,则K1>K2
C.反应:I2(aq)+I-(aq)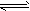 I3-(aq) △H>0
I3-(aq) △H>0
D.反应进行到状态D时,一定有v正<v逆
参考答案:B
本题解析:
本题难度:一般
3、选择题 已知ΔH大于0表示吸热反应;ΔH小于0表示放热反应。关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节诱发关节疼痛,其化学机理为:
①HUr(尿酸)+H2O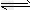 Ur-(尿酸根离子)+H3O+;
Ur-(尿酸根离子)+H3O+;
②Ur-(aq)+Na+(aq)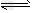 NaUr(s)
NaUr(s)
下列对反应②的叙述中正确的是
[? ]
A.反应的ΔH>0
B.降低温度,平衡向逆反应方向移动
C.反应的ΔH<0
D.升高温度,平衡向正反应方向移动
参考答案:C
本题解析:
本题难度:一般
4、选择题 密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g) ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图
2Z(g) ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图
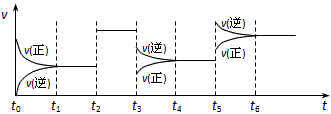
t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
[? ]
A.t4~t5时间内转化率一定最低
B.t3时降低了温度
C.t5时增大了压强
D.t2时加入了催化剂
参考答案:D
本题解析:
本题难度:一般
5、简答题 可逆反应H2(g)+I2(g)?2HI(g)达到平衡状态时的标志是( )
A.混合气体的体积恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等
参考答案:A、化学方程式的前后计量数大小相同,混合气体的体积不受反应影响,恒定不变,无法判断正反应速率与逆反应速率是否相等,故A错误;
B、I2蒸气是红棕色,混合气体颜色变浅,说明浓度降低,平衡向正反应方向移动,混合气体的颜色不再发生变化能确定达到平衡,故B正确;
C、反应混合物中各组成物质的浓度相等,不能说明反应v正=v逆,不能说明达到平衡状态,故C错误;
D、I2在混合气体中的体积分数与H2在混合气体中的体积分数相等,不能说明反应v正=v逆,不能说明达到平衡状态,故D错误.
故选B.
本题解析:
本题难度:一般