|
|
|
高考化学知识点归纳《化学平衡》试题强化练习(2019年最新版)(四)
2019-06-28 23:03:56
【 大 中 小】
|
1、选择题 温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是 PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s
| ? 0
| 50
| ? 150
| ? 250
| ? 350
| n(PCl3)/ mol
| ? 0
| 0.16
| ? 0.19
| ? 0.20
| ? 0.20
|
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
参考答案:C
本题解析:反应在前50 s时生成三氯化磷的物质的量是0.16mol,则反应在前50 s的平均速率为
v(PCl3)=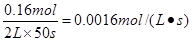 ,A不正确;升高温度,平衡时c(PCl3)=0.11mol·L-1>0.1mol/L,说明平衡向正反应方向移动,因此正反应是吸热反应,B不正确;根据表中数据可知,该反应的平衡常数是K= ,A不正确;升高温度,平衡时c(PCl3)=0.11mol·L-1>0.1mol/L,说明平衡向正反应方向移动,因此正反应是吸热反应,B不正确;根据表中数据可知,该反应的平衡常数是K=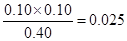 。当起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,此时 。当起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,此时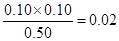 <0.025,则反应向正反应方向进行,即达到平衡前v(正)>v(逆),C正确;2.0mol PCl3和2.0molCl2就相当于是2mol五氯化磷,由于温度和容积不变,则和原平衡相比,相当于是增大压强,平衡向逆反应方向移动,因此五氯化磷的转化率降低,则三氯化磷的转化率增大,即达到平衡时,PCl3的转化率大于80%,D不正确,答案选C。 <0.025,则反应向正反应方向进行,即达到平衡前v(正)>v(逆),C正确;2.0mol PCl3和2.0molCl2就相当于是2mol五氯化磷,由于温度和容积不变,则和原平衡相比,相当于是增大压强,平衡向逆反应方向移动,因此五氯化磷的转化率降低,则三氯化磷的转化率增大,即达到平衡时,PCl3的转化率大于80%,D不正确,答案选C。
点评:该题属于可逆反应中较难的试题,难点在选项C和D上,其中选项D也可以借助于平衡常数进行定量计算,但计算过程较繁琐。不如借助于等效平衡进行定性分析。
本题难度:一般
2、选择题 在一定条件下,体积不变的密闭容器中,反应H2(g)+I2(g) 2HI(g)一定处于化学平衡状态的是 2HI(g)一定处于化学平衡状态的是
A.单位时间内有1mol H2消耗,同时有1mol I2生成
B.容器内的压强保持不变
C.H2(g)、I2(g)、HI(g)的浓度相等
D.单位时间内有1mol I-I键断裂同时有2mol H-I键形成
|
参考答案:A
本题解析:A 一定平衡,反应方向相反,速率相等
B 不一定平衡,因为此反应压强始终不变
C 不一定平衡,达平衡时各物质的浓度不变,不一定相等
D 不一定平衡,反应方向相同。故选A
本题难度:一般
3、选择题 下列事实不能用勒夏特列原理解释的是 ( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C.在含有Fe(SCN)3的红色溶液中加入铁粉,振荡静置,
D.氨水应密闭保存,置低温处
|
参考答案:B
本题解析:A 包含CO2的溶解平衡:CO2 (g) + H2O (g) =" H2CO3" (aq),打开啤酒瓶,压强减小,平衡向压强增大的方向移动,即向左移动
B H2+I2 2HI 增大压强,平衡不移动
2HI 增大压强,平衡不移动
C Fe3++3SCN- Fe(SCN)3加入铁粉,2Fe3++Fe=3Fe2+使c(Fe3+)减小,
Fe(SCN)3加入铁粉,2Fe3++Fe=3Fe2+使c(Fe3+)减小,
平衡左移,溶液颜色变浅或褪去。
D NH3+H2O NH3.H2O降低温度氨气的溶解度增大,平衡右移,有利于氨水的保存。
NH3.H2O降低温度氨气的溶解度增大,平衡右移,有利于氨水的保存。
本题难度:简单
4、选择题 下列说法中,不正确的是
[? ]
A.加入适当催化剂可以改变化学反应速率,但不可提高反应物的转化率
B.放热反应的反应速率一定比吸热反应的反应速率大
C.相同条件下,等体积的H2和空气含有相同数目的分子
D.常温常压下,1molN2和28gCO含有相同的原子数
参考答案:A
本题解析:
本题难度:一般
5、选择题 在一个固定容积的密闭容器中充入2molNO2,一定温度下建立如下平衡:2NO2

N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol?N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是( )
A.x>y
B.x<y
C.x=y
D.不能确定
参考答案:第一次达平衡后,再加入N2O4,N2O4的反应速率增大,因该容器是一个固定容积的密闭容器,所以加入N2O4后,反应体系的压强增大;增大压强,化学平衡向气体体积减小的方向移动,所以平衡向正反应方向移动,NO2的转化率增大,NO2的物质的量减小,体积分数也减小,故x>y.
故选A.
本题解析:
本题难度:一般
 2HI 增大压强,平衡不移动
2HI 增大压强,平衡不移动 Fe(SCN)3加入铁粉,2Fe3++Fe=3Fe2+使c(Fe3+)减小,
Fe(SCN)3加入铁粉,2Fe3++Fe=3Fe2+使c(Fe3+)减小, NH3.H2O降低温度氨气的溶解度增大,平衡右移,有利于氨水的保存。
NH3.H2O降低温度氨气的溶解度增大,平衡右移,有利于氨水的保存。