1、选择题 将下列物质分别加入或通入溴水中振荡,静置一段时间,水层颜色不变浅的是(? )
A.Mg粉
B.HI气体
C.CCl4
D.KCl溶液
参考答案:B
本题解析:溴水中有氢溴酸和次溴酸,镁可以和它们反应生成盐和氢气,生成的盐溶液是无色
的,随着反应的进行,溶解在水中的溴不断与水反应,最终溶液可以变成无色。HI气体溶于水后,与溴可以发生置换反应,生成碘和氢溴酸,碘水的颜色比较深,水层不变浅。CCl4与溴水混合后,CCl4可以萃取溴水中的溴,与水有明显的分层,水层颜色变浅。氯化钾与溴水不反应,溴水中加入氯化钾溶液后,原溶液被稀释,溶液颜色变浅。
本题难度:简单
2、选择题 下列各种说法正确的是( )
A.燃烧一定要有氧气参加,任何发光放热的剧烈的化学反应都可以叫做燃烧
B.新制氯水不但能使有色布条褪色,在光照时还能放出氯气
C.钠是一种还原性很强的金属,能把铜从硫酸铜溶液中置换出来
D.化学反应中一定有能量变化,这种变化以热能形式表现即为放热或吸热
参考答案:A.燃烧不一定有氧气参加,与氢气在氯气中燃烧,故A错误;
B.新制氯水中含有次氯酸,光照时次氯酸分解生成氧气,故B错误;
C.钠与硫酸铜溶液反应生成氢氧化铜沉淀和氢气,故C错误;
D.化学反应的实质是旧键的断裂和新键的形成,断裂化学键吸收能量,形成化学键放出能量,当吸收的能量多,放出的能量少时为吸热反应,反之为放热反应,故D正确.
故选D.
本题解析:
本题难度:简单
3、选择题 下列说法中,正确的是( )
A.亚硫酸钠溶液中加入氯化钡溶液后产生白色沉淀,再加稀盐酸沉淀不消失
B.正常雨水的pH等于7,pH小于7的雨水就是酸雨
C.二氧化硫能使品红溶液褪色,溶液受热后,溶液又变为红色
D.纯净的Cl2呈黄绿色,干燥的Cl2可以漂白干燥的有色布条
参考答案:A.亚硫酸钠和氯化钡反应生成不溶性的亚硫酸钡,亚硫酸的酸性小于盐酸,所以亚硫酸钡和盐酸反应生成可溶性的氯化钡,故A错误;
B.正常的雨水中溶于二氧化碳,二氧化碳和水反应生成碳酸,碳酸电离出氢离子,正常雨水的pH等于5.6,小于5.6的雨水是酸雨,故B错误;
C.二氧化硫能和颜色物质反应生成无色物质而具有漂白性,但二氧化硫的漂白性不稳定,受热后又恢复原色,故C正确;
D.氯气是黄绿色气体,氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性,所以干燥的Cl2不能漂白干燥的有色布条,故D错误;
故选C.
本题解析:
本题难度:一般
4、实验题 (8分)以下是实验室制取氯气的装置,在图中饱和食盐水的作用是_____________,
浓硫酸的作用是____________________,F中盛放的溶液是__________________________,
起的作用是_____________________________。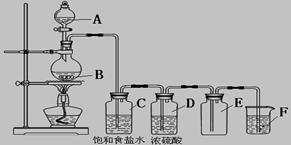
参考答案:吸收氯化氢,?干燥,?氢氧化钠溶液,?吸收尾气
本题解析:氯化氢易挥发,因此用饱和食盐水除去氯气中的氯化氢气体;浓硫酸具有吸水性,能干燥氯气;氯气属于大气污染物,需要尾气处理,因此氢氧化钠溶液是除去多余的氯气的。
本题难度:一般
5、填空题 浓硫酸在高中化学实验中有着很重要的作用
(1)①铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色固体。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解。过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。则黑色固体中含有________元素。
②实验室利用浓硫酸分别与氯化钠固体和碘化钾固体加热反应制取所需物质,分析这两个反应中浓硫酸作用的异同点:_________________________________ 。
(2)探究浓硫酸的吸水性。某同学把98%的硫酸10mL和63.3%的硫酸(用10mL 98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,根据室温环境下实验的数据绘成的曲线如图。由右图曲线你能得到的实验结论有哪些?(写两点)______、_______________。
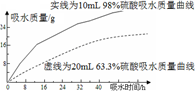
(3)苯与浓硝酸、浓硫酸制硝基苯的实验中,三种原料混合的顺序是_____________;要得到纯净的硝基苯,需经过:水洗 → 5%NaOH溶液洗涤 → 水洗 → 无水CaCl2干燥→________(填写操作),得到纯硝基苯。
(4)探究浓硫酸在生成乙酸乙酯反应中的作用。
问题提出:浓硫酸存在条件下酯化反应是否进行得更快。
设计实验:____________________。实验现象:___________________ 。
(5)浓硫酸与蔗糖反应的演示实验装置修改如下:实验时在大试管中先放入2g细小颗粒的蔗糖,滴加2—3滴碳酸钠浓溶液,再加入1.5mL 98%的浓硫酸,迅速塞紧带干燥管的单孔橡皮塞。可以看到,蔗糖迅速变黑,体积急剧膨胀,形成多孔海绵状固体物质——“黑面包”。分析实验效果更加明显的原因:____________________________________________________ 。
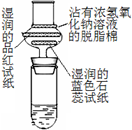
(6)苯分子等芳香烃化合物里的氢原子被硫酸分子里的磺酸基(—SO3H)所取代的反应,称为磺化反应。浓硫酸有时也用SO3代替浓硫酸,其优点是____________________、__________________。(至少写出两点)
用浓硫酸吸收SO3可得发烟硫酸(H2SO4·SO3)。某化工厂用1.5m3 98.3%的浓硫酸(密度为1.84g/mL)吸收SO3形成发烟硫酸,再与水混合,可得到95%的硫酸(密度为1.79g/mL)________m3(保留2位小数)。
参考答案:
(1)Cu、S;相同点均为难挥发性的酸,不同点后者还有强氧化性。
(2)98%硫酸和63.3%硫酸都具有吸水性; 98%硫酸吸水能力比63.3%硫酸强(吸水速度快、吸水量大)
(3)在浓硝酸中慢慢注入浓硫酸,摇匀冷却,在混合酸中慢慢滴入苯,使其混合均匀;蒸馏
(4)比较有、无浓硫酸存在条件下酯化反应进行的快慢;相同时间内有浓硫酸的反应收集到的油状物较多,无浓硫酸存在的反应几乎收集不到油状物。
(5)碳酸钠与浓硫酸反应及浓硫酸遇水均是放热过程,使体系温度升高,同时浓硫酸与碳酸钠反应产生二氧化碳使脱水后生成的炭更加疏松多孔。
(6)磺化时不生成水,废液少、反应快,三氧化硫用量可接近理论量。3.49 。
本题解析:
(1)①向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,证明溶液中含有Cu元素;向所得溶液加BaCl2溶液后有白色沉淀生成。证明溶液中含有SO42-,则又黑色固体中含有S元素。因此该固体中含有Cu、S量元素。
②浓硫酸与两种物质发生的反应为2NaCl+H2SO4(浓)  Na2SO4+2HCl↑;2NaI+2H2SO4(浓)
Na2SO4+2HCl↑;2NaI+2H2SO4(浓)  Na2SO4+2H2O+SO2↑+I2。在这两个反应中都利用了浓硫酸的难挥发性,不同的是后者还同时利用了它的强氧化性。
Na2SO4+2H2O+SO2↑+I2。在这两个反应中都利用了浓硫酸的难挥发性,不同的是后者还同时利用了它的强氧化性。
(2)由图中曲线能得到的实验结论有98%的硫酸和63.3%的硫酸都有吸水性;98%硫酸吸水能力比63.3%硫酸强;相同的时间98%的硫酸吸水量大;吸水相同量时98%的硫酸消耗时间短。
(3)在苯与浓硝酸、浓硫酸制硝基苯的实验中,酸的混合时与浓硫酸的稀释相似,即先加入密度小的物质,再加入密度大的物质。由于两种酸混合时放出大量的热,而苯的沸点较低,因此要等酸混合液冷却后再加入苯。故三种原料混合的顺序是在浓硝酸中慢慢注入浓硫酸,摇匀冷却,在混合酸中慢慢滴入苯,使其混合均匀;制得的硝基苯中含有硫酸、硝酸、水。要得到纯净的硝基苯,需经过水洗(除去大量的酸) → 5%NaOH溶液洗涤(中和剩余残留的少量的酸) → 水洗(除去表面的盐离子) → 无水CaCl2干燥(吸水)→最后蒸馏即可。
(4)设计实验:在两只相同的试管中分别加入等体积的无水乙酸、乙醇,然后向其中的一个试管中加入5ml的浓硫酸,把导气管通到盛有饱和Na2CO3溶液的试管中,要始终保持导气管管口在液面以上,给试管加热。观察在盛有饱和Na2CO3溶液的试管液面上油状物的多少及气味,比较有、无浓硫酸存在条件下酯化反应进行的快慢;结果发现:相同时间内有浓硫酸的反应收集到的油状物较多,无浓硫酸存在的反应几乎收集不到油状物。结论:浓硫酸存在条件下酯化反应进行得更快。浓硫酸在该反应中起催化剂、吸水剂的作用。
(5)碳酸钠与浓硫酸反应是放热反应;浓硫酸遇水也是个放热过程,这会使体系温度升高,温度升高,浓硫酸的氧化性增强,温度升高,化学反应速率加快;同时浓硫酸与碳酸钠反应产生二氧化碳可以使脱水后生成的炭更加疏松多孔。因此实验效果更明显。
(6)用SO3代替浓硫酸,可以减少水的产生,反应速率快,废物少.由发烟硫酸的化学式及元素在稀释过程在守恒可得:2×{(1.84×1.5×106×98.3%)÷98}=(1.79V×106×95%)÷98.整理可得V=3.49。
本题难度:一般