1、选择题 下列图示与对应的叙述相符的是( )

A.图1表示可逆反应“2X(g)?Y(g)△H<0”,温度T1<T2的情形
B.用0.1000?mol?L-1NaOH溶液分别滴定浓度相同的三种一元酸,由图2曲线可确定①的酸性最强
C.在其它条件不变时,2SO2(g)+O2(g)?2SO3(g)转化关系(如图3)中,纵坐标表示O2的转化率
D.图4表示碳酸钙与盐酸反应收集到气体最多的时间段是t3~t4
参考答案:A
本题解析:
本题难度:简单
2、填空题 常温下,将0.01 mol NH4Cl和 0.002 mol NaOH 溶于水配成1 L混合溶液,
!)该溶液中存在的三个平衡体系是:______________________________、
_______________________________、_______________________________。
溶液中共有_______种不同的粒子。
这些粒子中浓度为0.01 mol/L 的是_________,浓度为0.002 mol/L 的是_________。
(4)物质的量之和为0.01 mol的两种粒子是:___________和______________。
(5)_______和_______ 两种离子数量之和比OH-多0.008mol。
参考答案:(1) NH3·H2O  NH4+ + OH— NH4+ + H2O
NH4+ + OH— NH4+ + H2O  NH3·H2O+ H+
NH3·H2O+ H+
H2O H+ + OH— (每个方程式2分)
H+ + OH— (每个方程式2分)
(2) 七 (1分)
(3) Cl-; Na+ (每空1分)
(4) NH4+、NH3·H2O (每空1分)
(5) NH4+、H+ (每空1分)
本题解析:略
本题难度:一般
3、填空题 右图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答:

(1)该反应的反应物是 。
(2)该反应的化学方程式是: 。
(3)若达到平衡状态的时间为2min,则A的平均速率是 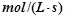 。
。
参考答案:(1)A (2)3A 3C + B (3)0.01
3C + B (3)0.01
本题解析:(1)根据图像可知,A物质的浓度降低,所以A物质是反应物。
(2)平衡时A的浓度减少了2.4mol/L-1.2mol/L=1.2mol/L,B和C的浓度分别增加了0.4mol /L和
1.2mol/L,则根据浓度的变化量之比是相应的化学计量数之比可知,反应的化学方程式是3A 3C + B。
3C + B。
(3)反应速率通常用单位时间内浓度的变化量来表示,则A的平均速率是1.2mol/L÷2min=0.6mol/(L·min)。
考点:考查可逆反应的有关判断和计算
点评:该题是中等难度的试题,试题基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生答题能力的培养。有利于调动学生的学习兴趣,提高学生应试能力和学习效率。该题的关键是在明确图像中曲线变化的基础上,灵活运用即可。
本题难度:一般
4、选择题 对于反应2SO2(g)+O2(g) 2SO3(g)能增大正反应速率的措施是(? )
2SO3(g)能增大正反应速率的措施是(? )
A.通入大量O2
B.增大容器容积
C.移去部分SO2
D.降低体系温度
参考答案:A
本题解析:增大反应物O2的浓度能够增大反应速率,A对;增大容器的容积,相当于减小压强,正、逆反应速率都减小,B错;移去部分SO2,瞬间SO2浓度减小,正反应速率减小,逆反应速率不变,C错;降低体系温度,正、逆反应速率都减小,D错。
本题难度:一般
5、选择题 低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)
?2N2(g)+3H2O(g)△H<0在恒容的密闭容器中,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率增大
C.单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
参考答案:A、正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,故A错误;
B、增大一个反应物浓度,其它反应物转化率增大,故B正确;
C、单位时间内消耗NO和N2的物质的量比为1:2时,等于化学计量数之比,反应到达平衡,故C正确.
D、使用催化剂平衡不移动,废气中氮氧化物的转化率不变,故D错误.
故选BC.
本题解析:
本题难度:简单