1、选择题 在一密闭容器中,反应m A(g)+n B(g)  3C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.25 mol/L。下列判断中正确的是( )
3C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.25 mol/L。下列判断中正确的是( )
A.A的质量分数增加 B.平衡发生移动
C.化学计量数:m+n=3 D.物质C的体积分数减小
参考答案:C
本题解析:在一密闭容器中,反应m A(g)+n B(g)  3C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,假设平衡不移动时,A的浓度应该是c(A)=0.25 mol/L,当达到新的平衡时,测得c(A)=0.25 mol/L,所以平衡不移动,即反应前后气体的化学计量数相同,所以m+n=3。故选C。
3C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,假设平衡不移动时,A的浓度应该是c(A)=0.25 mol/L,当达到新的平衡时,测得c(A)=0.25 mol/L,所以平衡不移动,即反应前后气体的化学计量数相同,所以m+n=3。故选C。
考点:压强对化学平衡的影响
点评:解答此题需知道以下知识,压强对化学平衡的影响的规律为:反应前后气体的化学计量数相同的化学反应,改变压强,平衡不移动。否则,平衡移动。
本题难度:困难
2、选择题 在一定温度下,向体积恒定为2 L的密闭容器里充入2 mol M和一定量的N,发生如下?反应:M(g)+N(g) E(g)。当反应进行到4min时达到平衡,测得M的浓度为0.2 mol·L-1。下列说法正确的是
E(g)。当反应进行到4min时达到平衡,测得M的浓度为0.2 mol·L-1。下列说法正确的是
A.4 min时,M的转化率为80%
B.4 min时,用M表示的反应速率为0.8 mol·L-1·min-1
C.4 min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.2 min时,M的物质的量浓度为0.6 mol·L-1
参考答案:A
本题解析:M的起始浓度为1mol/L,平衡为0.2mol/L,反应0.8mol/L,故转化率为80%;M的速率为0.8mol/L÷4min="0.2" mol·L-1·min-1;充入稀有气体,体积不变,不影响浓度;平衡不移动;只能算出平均速率,故中间状态浓度,不能求出。
本题难度:简单
3、简答题 (14分)研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 = +489.0 kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH 0 (填“>”、“<”或“=”)。
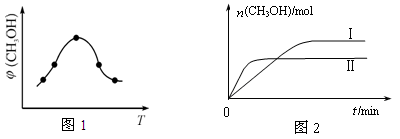
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。
当氨碳比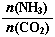 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
参考答案:(1)Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H = —28.5 kJ·mol-1
(2)① 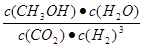 ;②< ; ③>
;②< ; ③>
(3)(2)2NH3+CO2 CO(NH2)2+H2O 40 % ②CO2+8e—+8H+=CH4+2H2O
CO(NH2)2+H2O 40 % ②CO2+8e—+8H+=CH4+2H2O
本题解析:(1) ①-②×3,整理可得Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H = —28.5 kJ/mol。(2)①化学平衡常数是可逆反应达到平衡状态时各种生成物浓度的幂指数的乘积与各种反应物浓度的幂指数的乘积的比。对该反应来说,K=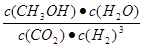 。②由甲醇的体积分数φ(CH3OH)与反应温度T的关系图示可知:当反应达到平衡后,升高温度,甲醇的体积分数减小,说明升高温度,化学平衡逆向移动。根据偏高移动原理:升高温度梦幻西游平衡向吸热反应方向移动。逆反应方向为吸热反应,所以正反应为放热反应。所以ΔH<0。 ③曲线Ⅱ比I先达到平衡。说明温度温度曲线Ⅱ>I。由于温度高,CH3OH含量低,说明化学平衡常数KⅠ>KⅡ。(3)①根据质量守恒定律,由CO2和NH3在一定条件下合成尿素[CO(NH2)2]的反应方程式为2NH3+CO2
。②由甲醇的体积分数φ(CH3OH)与反应温度T的关系图示可知:当反应达到平衡后,升高温度,甲醇的体积分数减小,说明升高温度,化学平衡逆向移动。根据偏高移动原理:升高温度梦幻西游平衡向吸热反应方向移动。逆反应方向为吸热反应,所以正反应为放热反应。所以ΔH<0。 ③曲线Ⅱ比I先达到平衡。说明温度温度曲线Ⅱ>I。由于温度高,CH3OH含量低,说明化学平衡常数KⅠ>KⅡ。(3)①根据质量守恒定律,由CO2和NH3在一定条件下合成尿素[CO(NH2)2]的反应方程式为2NH3+CO2 CO(NH2)2+H2O。
CO(NH2)2+H2O。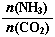 =3,假设n(CO2)=amol,则n(NH3)=3amol。由于达平衡时CO2的转化率为60%,所以反应消耗的n(CO2)=0.6amol.,根据方程式中二者的物质的量的关系可知反应的NH3的物质的量n(NH3)=1.2amol.所以氨气的转化率为(1.2amol.÷3amol)×100%=40%.②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,则根据题意可得:该电极反应的方程式为CO2+8e—+8H+=CH4+2H2O。
=3,假设n(CO2)=amol,则n(NH3)=3amol。由于达平衡时CO2的转化率为60%,所以反应消耗的n(CO2)=0.6amol.,根据方程式中二者的物质的量的关系可知反应的NH3的物质的量n(NH3)=1.2amol.所以氨气的转化率为(1.2amol.÷3amol)×100%=40%.②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,则根据题意可得:该电极反应的方程式为CO2+8e—+8H+=CH4+2H2O。
考点:考查热化学方程式的书写、化学平衡常数的表达式、温度对化学平衡常数的影响、物质转化率、电化学电极式的书写的知识。
本题难度:困难
4、选择题 已知C +CO2==2CO,其△H>0,反应速率为υ1,N2+3H2==2NH3,其△H<0,反应速率为υ2。对于上述反应,当温度升高时,υ1和υ2的变化情况为
[? ]
A. 同时增大
B. 同时减小
C. υ1增大, υ2减小
D. υ1减小, υ2增大
参考答案:A
本题解析:
本题难度:一般
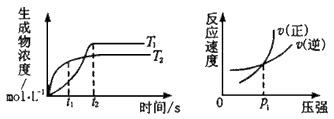
5、选择题 可逆反应aA(g)+bB(g)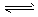 cC(g)+dD(g)ΔH同时符合图3中各曲线的规律的是?
cC(g)+dD(g)ΔH同时符合图3中各曲线的规律的是?
[? ]
A.a+b>c+d T1<T2 ΔH<0
B.a+b>c+d T1<T2 ΔH>0
C.a+b<c+d T1>T2 ΔH<0
D.a+b>c+d T1>T2 ΔH>0
参考答案:A
本题解析:
本题难度:一般