| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《离子共存》练习题(三)
5、填空题 最近雾霾天气肆虐我国大部分地区。其中SO2是造成空气的污染的主要原因,利用钠碱循环法可除去SO2。
①根据上表判断NaHSO3溶液显_______性,试解释原因__________________________; ②在NaHSO3溶液中离子浓度关系不正确的是_______(填序号)。 A.c(Na+)=2c(SO32-)+c(HSO3-) B.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) C.c(H2SO3)+ c(H+)=c(SO32-)+c(OH-) D.c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-) (4)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,电解示意图如下: 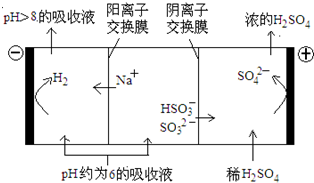 ①写出阳极上发生的电极反应式____________; ②当电极上有1mol电子转移时阴极产物的质量为__________。 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《三氧化硫》.. | |