| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《弱电解质电离平衡》高频考点强化练习(2019年最新版)(四)
参考答案:C 本题解析:A. NH3·H2O中加入少量NaOH固体,由原来的弱电解质变为了强电解质,导电能力明显增强。 本题难度:一般 3、选择题 在相同的温度下,100 mL 0.01 mol·L-1醋酸溶液与10 mL 0.1 mol·L-1醋酸溶液相比较,下列数值中前者大于后者的是 参考答案:D 本题解析:A、100 mL 0.01 mol·L-1醋酸溶液与10 mL 0.1 mol·L-1醋酸溶液中醋酸的物质的量相等,因此中和时所需氢氧化钠的物质的量相等,A不正确;B、醋酸的浓度越大,溶液的酸性越强,氢离子的浓度就越大。所以H+的物质的量浓度是前者小于后者,B不正确;C、电离平衡常数K只与温度有关系,所以两种醋酸溶液中电离平衡常数K相等,C不正确;D、醋酸是弱酸,存在电离平衡。稀释促进电离,所以将10 mL 0.1 mol·L-1醋酸溶液稀释到100 mL 0.01 mol·L-1醋酸溶液,溶液中氢离子的物质的量增加,D正确,答案选D。 本题难度:一般 4、选择题 电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。下图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。 下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是
[? ] A. 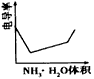 B. 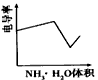 C.  D. 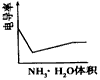 参考答案:D 本题解析: 本题难度:一般 5、选择题 某酸溶液中C(H+)=0.1mol?L-1,则该酸溶液的物质的量浓度为( ) |
参考答案:D
本题解析:由于不能确定酸的强弱以及酸的元数,所以酸的浓度是不能确定的,答案选D。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《离子共存》.. | |