1、实验题 (12分)控制变量法是研究化学变化量的重要思想方法。请仔细观察下表中50mL
稀盐酸和1g碳酸钙反应的实验数据:
实验
序号
| 碳酸钙
状态
| C(HCl)/ mol·l-1
| 溶液温度/℃
| 碳酸钙消失
时间/s
|
反应前
| 反应后
|
1
| 块状
| 0.5
| 20
| 39
| 400
|
2
| 粉末
| 0.5
| 20
| 40
| 60
|
3
| 块状
| 0.6
| 20
| 41
| 280
|
4
| 粉末
| 0.8
| 20
| 40
| 30
|
5
| 块状
| 1.0
| 20
| 40
| 120
|
6
| 块状
| 1.0
| 30
| 50
| 40
|
(1)该反应属于 反应(填“吸热”或“放热”)。
(2)实验5、6表明 对反应速率的影响。
(3)从本实验数据中分析,影响化学反应速率的因素还有 ,能表明这
一规律的实验序号是 。
参考答案:(1) 放热 (2) 温度 (3) 反应物接触面积 ①②
本题解析:(1)反应后溶液的无毒升高,说明反应是放热反应。
(2)实验5、6不同的是温度,因此探究的是温度对反应速率的影响。
(3)根据反应中的变量可知,不同的还有反应物的接触面积,因此影响化学反应速率的因素还有反应物接触面积,对应的实验是1、2。
本题难度:一般
2、填空题 对于下列反应:2SO2+O2?
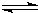
?2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为______,用O2浓度变化来表示的反应速率为______.如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L?min),那么2min时SO2的浓度为______.
参考答案:①v(SO2)=△C△t=6mol/L-2mol/L2min=2mol/L.min;
?②同一反应中,各物质的反应速率之比等于计量数之比,所以氧气的反应速率为二氧化硫的一半,所以是1mol/L.min;
③同一反应中,各物质的反应速率之比等于计量数之比,当氧气的反应速率为0.5 mol/(L?min)时,二氧化硫的反应速率为1mol/(L?min).
v(SO2)=△C△t=C开始-C2min△t=4mol/L-C2min2min=1mol/(L?min),C2min=2mol/L
本题解析:
本题难度:一般
3、选择题 在N2+3H2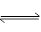 2NH3反应中,自反应开始至2 s末,氨的浓度由0变为0.4 mol·L-1,则以氢气的浓度变化表示该反应在2s内的平均反应速率是(?)
2NH3反应中,自反应开始至2 s末,氨的浓度由0变为0.4 mol·L-1,则以氢气的浓度变化表示该反应在2s内的平均反应速率是(?)
A.0.3 mol·L-1·s-1
B.0.4 mol·L-1·s-1
C.0.6 mol·L-1·s-1
D.0.8 mol·L-1·s-1
参考答案:A
本题解析:氨的浓度由0变为0.4 mol·L-1,则氨气表示的反应速率是0.4 mol·L-1÷2s=0.2 mol·L-1·s-1。又因为反应速率之比是相应的化学计量数之比,所以氢气的反应速率是0.3 mol·L-1·s-1,答案选A。
本题难度:简单
4、选择题 反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则表示此反应的速率正确的是( )
A.v(O2)=0.01mol?(L?s)-1
B.v(NO)=0.008mol?(L?s)-1
C.v(H2O)=0.003mol?(L?s)-1
D.v(NH3)=0.02mol?(L?s)-1
参考答案:由半分钟后,NO的物质的量增加了0.3mol,则用NO表示的化学反应速率为
V(NO)=△C△t=△nV△t=0.3mol5L30s=0.002mol?(L?s) -1
A、由化学反应速率之比等于化学计量数之比,则v(O2)=54V(NO)=54×0.002mol?(L?s)-1=0.0025 mol?(L?s)-1,故A错误;
B、用NO表示的化学反应速率为V(NO)=0.002mol?(L?s)-1,故B错误;
C、由化学反应速率之比等于化学计量数之比,则V(H2O)=64V(NO)=64×0.002mol?(L?s)-1=0.003 mol?(L?s)-1,故C正确;
D、由化学反应速率之比等于化学计量数之比,则V(NH3)=V(NO)═0.002mol?(L?s)-1,故D正确;
故选:CD.
本题解析:
本题难度:一般
5、选择题 已知C(s)+ CO2(g)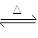 ?2CO(g)正反应为吸热反应,下列措施能使正反应速率加快的是(?)
?2CO(g)正反应为吸热反应,下列措施能使正反应速率加快的是(?)
①增加少量C(s)?②升高温度?③容器不变,再通入CO2?④缩小体积增大压强
A.①②③
B.①②③④
C.②③
D.②③④
参考答案:D
本题解析:考查外界条件对反应速率的影响。增大反应物浓度或升高温度或增大压强或使用催化剂都可以增大反应速率。碳是固体,其质量多少不影响反应速率。所以答案是D。
本题难度:简单