1、选择题 某反应X+3Y=2Z+2P在甲、乙、丙、丁四种不同条件下测得的反应速率为:
?甲: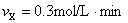
?乙: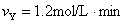
?丙:
?丁: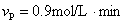
?则反应进行最快的是(?)
?
A.甲
B.乙
C.丙
D.丁
参考答案:D
本题解析:先将不同物质表示的速率换算成同一物质表示的速率,再比较
本题难度:简单
2、选择题 在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用υ(A)?υ(B)、υ(C)(mol?L-1?s-1)表示,且υ(A)、υ(B)、υ(C)之间有如下所示关系:υ(B)=3υ(A);3υ(C)=2υ(B).则此反应可表示为( )
A.2A+3B=2C
B.A+3B=2C
C.3A+B?2C
D.A+3B?2C
参考答案:可逆反应,A与B反应生成C,由于υ(B)=3υ(A);3υ(C)=2υ(B).
所以υ(A):υ(B):υ(C)=1:3:2.
所以反应为A+3B
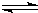
2C.
故选D.
本题解析:
本题难度:一般
3、简答题 某同学在用稀盐酸与铁制取氢气的实验中,发现加入少量氯化铜溶液可加快氢气的生成速率.请回答下列问题:
(1)要加快上述实验中气体产生的速率,还可采取的措施有______;______(答两种);
(2)实验室中现有NaCl、CuSO4、FeCl2、ZnCl2等4种溶液,可与实验中CuCl2溶液起相似作用的是______;
(3)为了进一步研究氯化铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验(混合溶液) | ?A | ?B | ?C | ?D | ?E | ?F
4mol/L?盐酸/mL
?60
?V1
?V2
?V3
?V4
?V5
饱和CuCl2溶液/mL
?0
?1.0
?5.0
?10
?V6
?40
H2O/mL
?V7
?V8
?V9
?V10
?20
?0
|
①请完成此实验设计,其中:V1=______,V6=______,V9=______;
②该同学最后得出的结论为:当加入少量CuCl2溶液时,生成氢气的速率会大大提高.但当加入的CuCl2溶液超过一定量时,生成氢气的速率反而会下降.
请分析氢气生成速率下降的主要原因______.
参考答案:(1)因升高温度、适当增加盐酸浓度、增大Zn的接触面积可加快反应速率,故答案为:升高温度;适当增加盐酸浓度;
(2)实验中加CuCl2溶液形成原电池加快反应速率,只有硫酸铜与Zn反应,则应选择CuSO4,故答案为:CuSO4;
(3)①研究氯化铜的量对氢气生成速率的影响,则盐酸的体积相同,则V1为60,改变氯化铜的量,由A、F可知结合溶液的总体积为60mL+40mL=100mL,则V6,=100-60-20=80,则V9=100-60-5=35,故答案为:60;20;35;
②当加入的CuCl2溶液超过一定量时,生成氢气的速率反而会下降是因生成Cu覆盖在Zn表面,降低了Zn与酸溶液的接触面积,故答案为:生成Cu覆盖在Zn表面,降低了Zn与酸溶液的接触面积.
本题解析:
本题难度:一般
4、选择题 设C+CO2
参考答案:
本题解析:
本题难度:一般
5、选择题 下列有关化学反应原理的说法不正确的是
A.强酸和强碱的中和反应的活化能接近于零,所以反应速率很高
B.过程的自发性既能用于判断过程的方向,也能用于判断过程发生的速率
C.电解质溶液导电的过程中,一定发生了电解质溶液的电解
D.溶解度较小的BaSO4在一定条件下也可以转化为溶解度略大的BaCO3