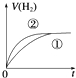
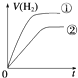
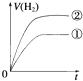
1、选择题 相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )
A.
B.
C.
D.
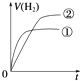
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列关于电解质溶液的叙述正确的是?(? )
A.室温下,pH=3的氢氟酸加水稀释后,电离常数Ka(HF)和pH均减小
B.室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
C.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中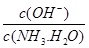 增大
增大
D.室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色
参考答案:D
本题解析:A、加水稀释,酸性会减弱,PH会变大,故A错误;B、PH=7,溶液呈中性,氢离子浓度等于氢氧根离子的浓度且,c(SO42-)=c(NH4+),故B错误;C、加入氯化铵抑制氨水的电离,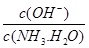 减小,故C错误。故选D。
减小,故C错误。故选D。
点评:本题考查学生溶液中离子浓度之间的守恒关系以及离子共存知识,考查学生分析和解决问题的能力,难度大。
本题难度:简单
3、选择题 常温下,0.1 mol/L某一元酸(HA)溶液中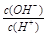 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中水电离出的c(H+)=10-10 mol/L
D.与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
参考答案:A
本题解析:常温下,水的离子积为1×10-14,结合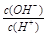 =1×10-8可得出,溶液中的
=1×10-8可得出,溶液中的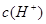 =1×10-3mol/L,可见一元酸没有完全电离,为弱酸:HA
=1×10-3mol/L,可见一元酸没有完全电离,为弱酸:HA H++OH—;
H++OH—;
A.溶液中加入一定量CH3COONa晶体,CH3COO—会结合溶液中的H+,使溶液中的c(H+)减少,c(OH-)必定增加;加水稀释,溶液酸性减弱,c(H+)减小,c(OH-)增大,符合题意
B.由上面的分析可知,溶液中的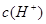 =c(A-)=1×10-3mol/L,错误
=c(A-)=1×10-3mol/L,错误
C.对于一元酸溶液来说,水电离出的c(H+)等于溶液中c(OH-),即10-11mol/L,排除
D.所给离子顺序,很明显违背了电荷守恒原则,排除。
故答案为A
本题难度:一般
4、选择题 醋酸溶液中存在电离平衡: 下列叙述不正确的是
下列叙述不正确的是
[ ? ]
A.CH3COOH溶液中离子浓度的关系满足:
B.0.1 mol/L 的CH3COOH 溶液加水稀释,溶液中c( )减小
)减小
C.CH3COOH溶液中加入少量CH3COONa固体.平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后,溶液的pH<7
参考答案:B
本题解析:
本题难度:一般
5、选择题 室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是?
A.加适量的醋酸钠晶体后,两溶液的pH均增大
B.使温度都升高20℃后,两溶液的pH均不变
C.加水稀释2倍后,两溶液的pH均减小
D.加足量的锌充分反应后,两溶液产生的氢气一样多
参考答案:A
本题解析:A选项,加入醋酸钠晶体为碱性,故加入后两溶液PH均增大。正确。B选项,升高温度后,KW值增大故PH值均降低。故错误。C选项,加水稀释后,氢离子浓度均下降,PH值均增高。D选项,pH相同体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,故加入足量锌后,醋酸产生的氢气量多。D错误。
本题难度:一般