| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《弱电解质电离平衡》高频试题特训(2019年最新版)(四)
参考答案:B 本题解析:A、溶液导电能力取决于溶液中离子浓度大小,强电解质溶液的导电性不一定比弱电解质溶液的导电性强,A错误;B、强电解质的特征是水溶液中完全电离,所以不存在溶质分子,B正确;C、离子化合物都是强电解质,但强电解质不一定是离子化合物;弱电解质都是共价化合物,但共价化合物不一定是弱电解质;C错误;D、不同弱电解质电离程度由本性决定,浓度相同的弱电解质溶液中电离程度不一定相同,D错误;选B。 本题难度:一般 2、填空题 (1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是______(填“A”或“B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1______m2 参考答案:(1)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2. 本题解析: 本题难度:一般 3、选择题 0.1 mol·L-1的下列物质的水溶液,只存在一种分子的是( ) |
参考答案:D
本题解析:NaF是强碱弱酸盐,水解显碱性,溶液中有H2O和HF两种分子。NH4Cl是强酸弱碱盐,水解显酸性,溶液中有H2O和NH3·H2O两种分子。HClO是弱酸,存在电离平衡,溶液中有H2O和HClO两种分子。硝酸是强酸,在溶液中全部电离,只有水分子。所以答案选D。
本题难度:一般
4、选择题 在已达到电离平衡的0.1 mol·L-1的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH降低,应采取的措施是?
? [? ]
参考答案:B
本题解析:
本题难度:一般
5、简答题 亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生和Na2HPO3.
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式______.
②某温度下,0.1000mol?L-1的H3PO3溶液pH的读数为1.6,即此时溶液中c(H+)=2.5×10-2mol?L-1,除OH-之外其他离子的浓度由小到大的顺序是______,该温度下H3PO3电离平衡的平衡常数K=______.(H3PO3第二步电离忽略不计,结果保留两位有效数字)
③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中c(Na+)______c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”).
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式______.
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如图:说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过
①阴极的电极反应式为______.
②产品室中反应的离子方程式为______.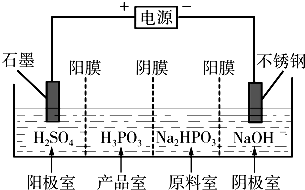
参考答案:(1)①亚磷酸是二元酸,亚磷酸和少量氢氧化钠反应生成NaH2PO3、H2O,所以该反应方程式为:H3PO3+OH-=H2PO3-+H2O,故答案为:H3PO3+OH-=H2PO3-+H2O;
②0.1000mol?L-1的H3PO3溶液pH的读数为1.6,氢离子浓度小于亚磷酸浓度,所以亚磷酸是二元弱酸,在水中分步电离,且第一步电离程度大于第二步,两步电离中都有氢离子生成,所以氢离子浓度最大,离子浓度大小顺序是c(HPO32-)<c(H2PO3-)<c(H+),
H3PO3 ?H++H2PO3-
起始时各物质浓度(mol?L-1)0.1000
反应的各物质的浓度(mol?L-1)2.5×10-2 2.5×10-22.5×10-2
平衡时各物质的浓度(mol?L-1)0.10-2.5×10-2 2.5×10-22.5×10-2K=c(H+)?c(H2PO3-)c(H3PO3)=2.5×10-2×2.5×10-20.10-2.5×10-2=8.3×10-3mol?L-1
故答案为:c(HPO32-)<c(H2PO3-)<c(H+),8.3×10-3mol/L;
③溶液呈中性,则C(H+)=C(OH-),溶液呈电中性,则c(Na+)+C(H+)=C(OH-)+c(H2PO3-)+2c(HPO32-),因为C(H+)=C(OH-),所以c(Na+)=c(H2PO3-)+2c(HPO32-),故答案为:=;
(2)碘具有强氧化性,亚磷酸具有强还原性,所以亚磷酸和碘能发生氧化还原反应生成氢碘酸和磷酸,反应方程式为:
H3PO3+I2+H2O=2HI+H3PO4,故答案为:H3PO3+I2+H2O=2HI+H3PO4;
(3)①阴极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②产品室中HPO32-和氢离子结合生成亚磷酸,反应离子方程式为:HPO32-+2H+=H3PO3,故答案为:HPO32-+2H+=H3PO3.
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《阿伏伽德罗.. | |