1、填空题 (17分)过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,用作杀菌剂、防腐剂、解酸剂、油类漂白剂及封闭胶泥的快干剂,在食品、牙粉、化妆品等制造中用作添加剂。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
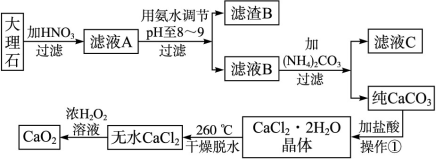
请回答下列问题:
(1)操作①中应包括?、?、?用氨水调节pH至8~9的目的是______________。
(2)若测得滤液C中c(CO )=2.50×10-4 mol·L-1,则Ca2+_?_____(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
)=2.50×10-4 mol·L-1,则Ca2+_?_____(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH )?c(NO
)?c(NO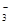 ) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为?。
) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为?。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式:_______________,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。用简要的文字解释需用氢氧化钠调节pH至9~11的原因_________________________。
(5)写出CaO2与H2O反应的化学方程式?。
参考答案:(1)溶解、过滤、蒸发结晶(3分);除去Fe3+或使Fe3+转化为Fe(OH)3沉淀被除去(2分)
(2)否(2分)
(3)<(2分)? c(NH4+)>c(CO32?)>c(OH?)>c(H+) (2分)
(4)CaCl2+H2O2 CaO2+2HCl(2分) 加入NaOH溶液使上述平衡向正反应方向移动,有利于CaO2沉淀的生成(2分)
CaO2+2HCl(2分) 加入NaOH溶液使上述平衡向正反应方向移动,有利于CaO2沉淀的生成(2分)
(5)2CaO2+2H2O=2Ca(OH)2+O2↑(2分)
本题解析:(1)沉淀碳酸钙用盐酸溶解然后蒸发结晶可以得到氯化钙晶体;因大理石中的主要杂质是氧化铁,它与硝酸反应生成了Fe(NO3)3,在调节pH到8~9时,Fe3+会以Fe(OH)3沉淀形式进入滤渣,从而除去了杂质离子Fe3+。
(2)根据离子积Ksp(CaCO3)=4.96×10-9=c(Ca2+)·c(CO ),得c(Ca2+)=4.96×10-9/2.50×10-4 mol·L-1=1.98×10-5 mol·L-1 > 10-5 mol·L-1,没有沉淀完全。
),得c(Ca2+)=4.96×10-9/2.50×10-4 mol·L-1=1.98×10-5 mol·L-1 > 10-5 mol·L-1,没有沉淀完全。
(3)由电荷守恒:c(H+)+c(NH )=c(OH-)+c(NO
)=c(OH-)+c(NO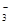 ),因c(H+)>c(OH-),故c(NH
),因c(H+)>c(OH-),故c(NH )<c(NO
)<c(NO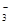 )。
)。
(4)由CaCl2+H2O2 CaO2+2HCl,加入NaOH溶液,NaOH与HCl发生中和反应,减少了生成物浓度,使上述平衡向正反应方向移动,有利于CaO2沉淀的生成。
CaO2+2HCl,加入NaOH溶液,NaOH与HCl发生中和反应,减少了生成物浓度,使上述平衡向正反应方向移动,有利于CaO2沉淀的生成。
(5)CaO2中O元素的化合价为—1价,部分化合价升高转化为O2,部分化合价降低转化为Ca(OH)2,所以化学方程式为:2CaO2+2H2O=2Ca(OH)2+O2↑
本题难度:困难
2、选择题 下列实验操作或说法中错误的是(双选)( )
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
参考答案:AD
本题解析:试题分析:A选项,乙醇因为与水互溶,不能作为水体系的萃取剂。D选项,萃取操作时,对萃取剂的要求:一是和原溶剂互不相溶且不反应,与溶质也不能反应;二是溶质在萃取剂中的溶解度要大于在原溶剂中的溶解度;三是萃取剂与原溶剂密度有差异,但其密度不一定比水大,所以答案选AD。
考点:考查化学实验基本操作的有关判断
点评:该题是常识性知识的考查,主要是考查学生对常见仪器使用以及常见化学实验原理的熟悉了解程度,主要是有利于培养学生规范严谨的实验操作动手能力,提升的学生学科素养,激发学生的学习兴趣和学习积极性。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
3、实验题 下图表示从固体混合物中分离X的2种方案,请回答有关问题。

(1)选用方案I时,X应该具有的性质是_________,残留物应该具有的性质是____________;
(2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是____________,有关反应的化学方程式为_______________________;
(3)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作) ________________________。
参考答案:(1)有挥发性(或易升华);受热不挥发,且具有较高的热稳定性
(2) HNO3 ;

(或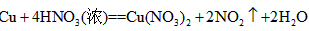
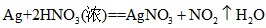 )
)
(3) 
本题解析:
本题难度:一般
4、选择题 下列实验中,依据实验操作及现象,得出的结论正确的是(?)
?
| 操 作
| 现 象
| 结 论
|
A
| 测定等浓度的Na2CO3和Na2SO3 溶液的pH
| 前者pH比后者的大
| 非金属性: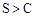
|
B
| 无色溶液中滴加氯水和CCl4,振荡、静置
| 下层溶液显紫色
| 原溶液中有
|
C
| 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中
| 生成白色沉淀
| 溶液X中一定含有 或 或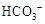
|
D
| 向某无色溶液中滴加硝酸酸化的BaCl2溶液
| 产生白色沉淀
| 溶液中不一定含有
参考答案:BD
本题解析:比较S和C的非金属性,应该比较对应元素的最高价氧化物的水化物的盐溶液的PH,所以A错误;能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,所以C项错误;BD正确,故选BD。
本题难度:一般
5、选择题 对于某些离子的检验及其结论一定正确的是(? )
A.加入稀盐酸产生无色无味气体,将气体通入石灰水中,变浑浊,一定有CO3 2-
B.加入BaCl2溶液产生白色沉淀,再加上稀盐酸沉淀不消失,一定有SO42-
C.加入足量稀盐酸无沉淀,再加BaCl2溶液有白色沉淀,一定有SO42-
D.加入Na2CO3溶液产生白色沉淀,再加稀盐酸白色沉淀消失,一定有Ba2+
参考答案:C
本题解析:A.加入稀盐酸产生无色无味气体,将气体通入石灰水中,变浑浊,则溶液中可能含有CO32-也可能含有HCO32-。错误。B.加入BaCl2溶液产生白色沉淀,再加上稀盐酸沉淀不消失,可能含有Ag+,也可能有SO42-。错误。C.加入足量稀盐酸无沉淀,排除了含有Ag+的可能;再加BaCl2溶液有白色沉淀,则一定有SO42-。正确。D.加入Na2CO3溶液产生白色沉淀,再加稀盐酸白色沉淀消失,可能含有Ca2+,也可能是一有Ba2+。错误。32-、SO42-、 Ba2+等离子的检验方法的知识。
本题难度:一般
|