1、选择题 铅蓄电池在现代生活中有广泛应用,其电极材料是Pb 和PbO2,电解液是H2SO4溶液。现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
A.蓄电池放电时,电路中每转移2 mol电子,最多有1 molPbO2被还原
B.电解池的阳极反应式为:4OH--4e-=2H2O+O2↑
C.电解后, c(Na2SO4)不变,且溶液中有晶体析出
D.蓄电池中每生成1mol H2O,电解池中就消耗1mol H2O
参考答案:D
本题解析:A.蓄电池放电时,发生的反应是Pb+ PbO2+ 2H2SO4=2PbSO4+2H2O.电路中每转移2 mol电子,最多有1 molPbO2被还原。正确。B.在Na2SO4溶液中含有的阴离子是OH-、SO42-,由于放电能力:OH->SO42-。所以在电解池的阳极反应式为:4OH--4e-=2H2O+O2↑。正确。C.电解Na2SO4溶液,实质就是电解水,电解后, 由于水减小,原来的饱和溶液中水溶解的溶质不能再溶解,就会溶液中有晶体析出,但是c(Na2SO4)不变。正确。D.在整个闭合回路中电子转移数目相等。在蓄电池中每生成1mol H2O,转移电子1mol.而在电解池中就消耗0.5mol H2O.
本题难度:一般
2、填空题 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的1/4。
(1)钢铁腐蚀主要是吸氧腐蚀,写出该腐蚀过程中的电极反应式。 正极:____;负极:____
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,其中焊接在铁闸门的固体材料R可以采用____(请写出具体金属)。
(3)下图中乙方案也可降低铁闸门腐蚀速率,其中铁闸门应该连接在直流电源的____极。

参考答案:(1)O2+4e-+2H2O==4OH- ;2Fe-4e-==2Fe2+
(2)锌或镁等活泼金属
(3)负
本题解析:
本题难度:一般
3、选择题 钠硫高能蓄电池的结构如图,M为Na2O和Al2O3的混合物,电池的反应原理为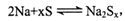 电池工作温度为320℃。下列说法错误的是
电池工作温度为320℃。下列说法错误的是
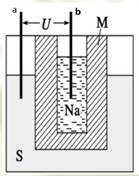
A.a为电池正极,b为电池负极
B.电池放电时,正极反应为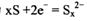
C.电池充电时.Na所在电极连接电源正极
D.M的作用为导电和隔离钠和硫
参考答案:C
本题解析:Na只具有还原性,发生氧化反应所以b为负极,A正确;充电时钠所在的极发生还原反应,故应接电源的负极,C错。
本题难度:一般
4、选择题 钢铁生锈过程发生如下反应:①2Fe+O2+2H2O=2Fe(OH)2; ②4Fe(OH)2+O2+2H2O=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O。下列说法正确的是
[? ]
A.反应①、②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
参考答案:A
本题解析:
本题难度:简单
5、填空题 (12分)有右图装置:回答下列问题:
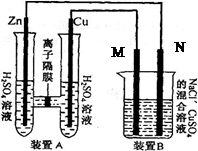
(1)装置A是_______池,B是_______池。?
(2)装置A中的Zn极是_______极,
Cu极上的电极反应方程式为:__________________。?
(3)装置B中是浓度均为1.0mol/L的NaCl、CuSO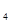 混合溶液,溶液体积为500mL,M、N均为石墨电极,当装置A中Zn棒质量减少32.5g时,N上质量增加____________g;
混合溶液,溶液体积为500mL,M、N均为石墨电极,当装置A中Zn棒质量减少32.5g时,N上质量增加____________g;
(4)欲用装置B给用来给餐具镀银,N应该是??(填“银” 或“餐具”),?电镀液的主要成分是(填化学式)?。
参考答案:((1)小题每格1分,其余2分)(1)原电池;?电解池;
(2)负;Cu极上的电极反应式;H2-2e-=H2↑;
(3) 32 g;?(4)餐具; AgNO 3?;
本题解析:(1)根据装置图中电解材料的性质及电解质溶液可知,A是铜锌原电池,B是电解池。
(2)原电池中较活泼的金属作负极,所以锌是负极,铜是正极,溶液中的氢离子在正极得到电子生成氢气,反应式为H2-2e-=H2↑。
(3)A中Zn棒质量减少32.5g时,转移电子是32.5g÷65g/mol×2=1.0mol。N和电源的负极相连,是阴极,溶液中的铜离子放电。溶液中铜离子的物质的量是1mol/L×0.5L=0.5mol,恰好需要1mol电子,生成0.5mol铜,质量是32g。
(4)电镀时待镀金属作阴极,镀层金属作阳极,含有镀层金属离子的溶液作电镀液,N是阴极,连接餐具,可以用硝酸银作电镀液。
本题难度:简单