1、填空题 如图所示,水槽中试管内有一枚铁钉,放置数天观察:

⑴铁钉在逐渐生锈,则铁钉的腐蚀属于?腐蚀。
⑵若试管内液面上升,则原溶液是?性,发生?腐蚀,电极反应:负极:?,正极:?。
⑶若试管内液面下降,则原溶液是?性,发生?腐蚀,电极反应:负极:?,正极:?。
⑷若溶液甲为水,溶液乙为海水,则铁钉在?(填“甲”或“乙”)溶液中腐蚀的速度快。
参考答案:⑴电化学;⑵弱酸性或中性?吸氧? 2Fe → 2Fe2++4e-? O2 + 2H2O+4e-→4OH-;⑶较强的酸性?析氢?Fe → Fe2++2e-? 2 H++ 2e-→ H2↑;⑷乙。
本题解析:铁钉是铁合金,易发生电化学腐蚀。依据腐蚀的条件、原理、结果及速度可知答案。铁钉是铁合金,主要由铁和炭组成,外加电解质溶液,可构成原电池,此时发生的腐蚀属于电化学腐蚀。依据腐蚀的条件、原理及结果可知:试管内液面上升,说明试管压强减小,气体被吸收,是发生吸氧腐蚀的结果,据此写出电极反应。试管内液面下降,说明试管压强增大,产生气体所致,是发生析氢腐蚀的结果,据此写出电极反应。对于同一金属来说,在强电解质溶液中腐蚀速度>在弱电解质溶液中腐蚀速度。
本题难度:简单
2、选择题 随着人们生活质量的不断提高,废电池必须集中处理的问题越来越受到重视.其主要原因是(? )
A.回收废电池外壳的金属材料
B.防止废电池中的汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗漏的电解液腐蚀其他物品
D.提炼稀有金属
参考答案:B
本题解析:一般电池中都有重金属离子大量存在,废置于露天的环境中,这些重金属离子随水渗入地下,污染土壤、污染地下水、污染农植物,危害极其长久。这是废电池集中处理的关键原因.
本题难度:一般
3、填空题 下图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,利用2Na2S2+NaBr3 Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。
Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。

(1)当蓄电池工作放电时,电池中Na+的移动方向是:____?(填“电极a→b”或“电极b→a”),电极a的电极名称为?,发生的电极反应为?。
(2)当蓄电池处于充电状态时,电极a应接外电源?极(填“正”或“负”),电极b的电极名称为?,发生的电极反应为?。
(3)若左侧储罐的中溶液体积为VL(导管、泵及电池内部溶液忽略不计),一段时间观察,溶液中Na+的平均浓度由c1mol·L-1降至c2mol·L-1,则此装置该段时间正处于?(填“放电”或“充电”)状态,此过程中电极b上转移电子的物质的量共有__??mol。
参考答案:(1)电极b→a (2分) 正极(1分)? Br— 3+2e-=3Br-(2分)
(2)正(2分)?阴极(2分)? S2— 4+2e-=2S2— 2(2分)?(3)充电(2分)? (c1—c2)V(2分)
本题解析:(1)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据总的反应方程式可知,Na2S2失去电子,被氧化,所以b电极是负极,因此当蓄电池工作放电时,电池中Na+的移动方向是电极b→a。电极a的电极名称为是正极,发生还原反应,因此电极反应式是Br— 3+2e-=3Br-。
(2)电极a是正极,因此当蓄电池处于充电状态时,电极a应接外电源正极。电极b与外接电源的负极相连,作阴极,得到电子,发生还原反应,因此此时电极反应式是S2— 4+2e-=2S2— 2。
(3)放电时钠离子向左侧移动,因此当左侧钠离子浓度降低时,说明处于充电状态。钠离子带1个正电荷,所以根据电荷守恒可知,此过程中电极b上转移电子的物质的量共有(c1—c2)mol/L×VL=(c1—c2)V。
本题难度:一般
4、选择题 下列叙述正确的是 (? )
A.铜锌原电池中铜是负极
B.用电解法精炼铜时粗铜作阴极
C.铅蓄电池放电时的负极在充电时作阴极
D.电解稀硫酸制H2、O2时可用铜作阳极
参考答案:C
本题解析:A 错 铜锌原电池中锌是负极
B 错用电解法精炼铜时粗铜作阳极
C 对,和电源负极相连的是电极的阴极
D 对电解稀硫酸制H2、O2时,阳极一定是惰性电极。
本题难度:简单
5、填空题 (11分)如图装置,A、B中的电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极.若A、B中充满KOH溶液后倒立于KOH溶液的水槽中.切断K1,合闭K2、K3通直流电,回答下列问题:
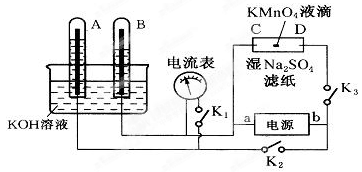
①判断电源的正、负极:a为________极,b为________极。
②在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,有什么现象 。
③写出电极反应式:A极 ,C极 。
④若电解一段时间后,A、B中均有气体包围电极.此时切断K2、K3,合闭K1,则电流表的指针是否移动(填是或否) 。说明理由____________________________。
参考答案:(11分)①负、正。(2分)? ②紫色向D方向移动,两极有气体产生。(2分)
③4OH――4e=2H2O+O2↑,4H++4e=2H2↑。(4分)? ④是;组成氢氧燃料电池。(3分)
本题解析:①惰性电极电解氢氧化钾溶液的实质是电解水,阴阳极分别生成氢气和氧气。根据试管B中气体的体积大可知,生成的气体是氢气,即B是阴极,则a是负极,b是正极。
②惰性电极电解硫酸钠的实质也是电解水,阴极生成氢气,阳极生成氧气。电解池中阳极失去电子,所以溶液中的阴离子向阳极移动,则实验现象就是紫色向D方向移动,两极有气体产生。
③A电极是阳极,OH―放电生成氧气,电极反应式是4OH――4e=2H2O+O2↑;C电极是阴极,氢离子放电生成氢气,电极反应式是4H++4e=2H2↑。
④由于A中生成氧气,B中生成氢气。所以此时切断K2、K3,合闭K1,则构成氢氧燃料电池,所以电流表的指针发生移动。
点评:原电池的判断关键是正负极的判断,依据是在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断;电解池中电解产物的判断是难点,方法是首先判断阳极电极材料。如果是活性电极,则电极本身失去电子。如果是惰性电极,则溶液中的阴离子失去电子。而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序。
本题难度:一般