1、选择题 某小组为研究电化学原理,设计如图装置。下列叙述错误的是
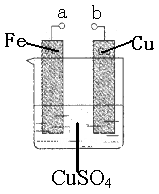
A.a和b不连接时,铁片质量会增加
B.a和b用导线连接时,正极发生的电极反应为:Cu2++2e-=Cu
C.无论a和b是否连接,铁片均被腐蚀
D.a和b分别连接电源正、负极时,Fe电极发生的电极反应为:4OH--4e-=2H2O+O2↑
参考答案:D
本题解析:
试题分析:A、a和b不连接时,铁与硫酸铜发生置换反应生成铜与硫酸亚铁。生成的铜附着在铁片上,因此铁片质量会增加,A正确;B、a和b用导线连接时构成原电池,铁的金属性强于铜,因此铁是负极,铜是正极,则正极发生的电极反应为:Cu2++2e-=Cu,B正确;C、a和b用导线连接时构成原电池,铁的金属性强于铜,因此铁是负极失去电子而被腐蚀。a和b不连接时,铁与硫酸铜发生置换反应生成铜与硫酸亚铁而被腐蚀,C正确;D、a和b分别连接电源正、负极时,构成电解池。Fe电极是阳极,失去电子,发生的电极反应为:Fe-2e-=Fe2+,D不正确,答案选D。
本题难度:一般
2、选择题 如图所示,将紧紧缠绕不同金属丝的铁钉放入培养皿中,再加入含有适量NaCl的溶液。下列叙述正确的是
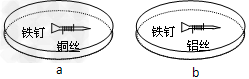
[? ]
A.a中铜丝上发生氧化反应
B.b中铁钉上发生还原反应
C.a、b中的铁钉均会发生锈蚀?
D.a、b中反应时均有氢气放出
参考答案:B
本题解析:
本题难度:一般
3、填空题 Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜。回答有关问题。
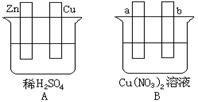
(1)导线将容器A和B连接时,Zn接?,Cu接?(填“a”或“b”)
(2)容器A中Cu极发生的电极反应为?。
(3)B装置叫?,溶液中的NO3-向_____极移动(填“a”或“b”)。
(4)若b极观察到有无色无味气泡产生, 经过一段时间后,停止反应并搅拌均匀,溶液的pH值将?(填“升高”、“降低”或“不变”),加入一定量的?后(填化学式),溶液能恢复至与反应前完全一致。若反应一段时间后,测得溶液中Cu2+浓度没有明显下降,可能的原因是:?。
Ⅱ.炒菜的铁锅没有洗干净容易生锈。用必要的文字和有关化学方程式说明铁锈是如何形成的?
?
?
?。
参考答案:Ⅰ.(1)a,b (2)2H+ + 2e- = H2↑(3)电解池,b(或阳)
(4)降低,CuO?b极材料为Cu
Ⅱ.铁锅是生铁制造的,生铁中的Fe、C和炒菜未洗净的食盐水构成原电池(1分),使铁发生电化学腐蚀生成Fe(OH)2, Fe(OH)2再被氧化成Fe(OH)3,Fe(OH)3部分失水得到铁锈。负极:2Fe - 4e- = 2Fe2+;正极:O2 + 2H2O +4e- = 4OH-;
4Fe(OH) +O2 +2H2O = 4Fe(OH)3
本题解析:I.A可形成原电池,Zn作负极,Cu作正极,使a极析出铜,a极为阴极,所以a与Zn连接,b与Cu连接。A中Cu极发生的反应为2H++2e-=H2↑、Zn极发生的反应为Zn-2e-=Zn2+。B装置叫电解池,溶液中NO3-向阳极移动。电解硝酸铜溶液生成铜、硝酸和氧气,溶液酸性增强,pH减小,阳极析出氧气、阴极析出铜,加入氧化铜能使溶液浓度恢复到反应前浓度,若反应一段时间后Cu2+浓度没有明显下降,说明阳极溶解Cu生成Cu2+。II.铁生锈的机理是铁、炭、食盐水形成原电池,Fe为负极,Fe-2e-=Fe2+。炭为正极,电极反应为O2+2H2O+4e-=4OH-,总反应为2Fe+O2+2H2O=2Fe(OH)2,Fe(OH)2被氧化为Fe(OH)3、Fe(OH)3失水生成Fe2O3·xH2O。
点评:钢铁电化腐蚀分两种:吸氧腐蚀和析氢腐蚀,当电解质溶液酸性较强时,发生析氢腐蚀;当电解质溶液呈中性或碱性时发生吸氧腐蚀,
本题难度:一般
4、选择题 关于下图所示各装置的叙述中,正确的是?(?)
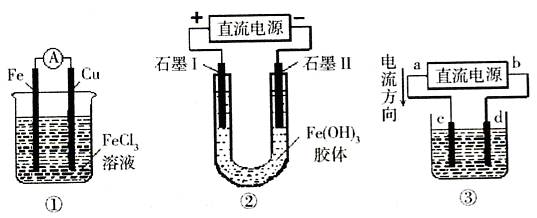
A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+
B.装置①中,铁做负极,电极反应式为:Fe3++e-=Fe2+
C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
参考答案:
C
本题解析:
本题考查电化学知识;装置①为原电池,铁为负极,电极反应式为:Fe-2e-=Fe2+,铜为正极,总反应是Fe+2Fe3+=3Fe2+,A、B错误;装置②中,Fe(OH)3胶粒带正电,向阴极移动,阴极附近溶液颜色加深,C正确;粗铜精制,精铜做阴极,粗铜做阳极,电解质溶液为CuSO4溶液,D错误。
本题难度:一般
5、填空题 (15分)a、b、c、d、e为短周期主族元素。其中
①a和b属同周期元素,二者能形成多种气态化合物;
②a和c属同周期元素,二者能形成两种气态化合物;
③a和d属同主族元素,二者能形成两种常见化合物;
④e可分别和a、b、c、d形成具有相同电子数的共价化合物甲、乙、丙、丁。
请回答:
(1)a元素为____?,甲的分子式为?,丁的电子式为?。
(2)由上述一种或几种元素形成的物质可与水发生氧化还原反应,写出一个符合要求的化学反应方程式:?。
(3)a单质和丙可形成燃料电池(以KOH溶液为电解质)。该燃料电池的负极反应式为
?。
(4)乙是一种液态火箭燃料,在O2中燃烧,产物无污染。常温下,6.4 g乙燃烧放出QkJ热量,该反应的热化学方程式为____?。
参考答案:(15分)
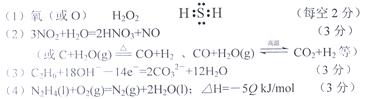
本题解析:略
本题难度:一般