| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《金属的腐蚀与防护》试题特训(2019年最新版)(六)
(3)充电时该电池阳极的电极反应式? (4)用此蓄电池分别电解以下两种溶液,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,试回答下列问题。 ①电解M(NO3)x溶液时某一电极增加了 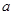 g M,则金属M的相对原子质量为?(用含“ g M,则金属M的相对原子质量为?(用含“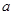 、x”的表达式表示)。? 、x”的表达式表示)。?②电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100mL,阳极产生的气体在标准状况下的体积是?;将电解后的溶液加水稀释至1L,此时溶液的PH=?。 参考答案:(1) A? (2) 增大?(3) Ni(OH)2 -2e + 2OH- ="=" NiO2 + 2H2O 本题解析:(1)得到电子,化合价较低的反应是还原反应,原电池中正极得到电子,发生还原反应,负极失去电子,发生氧化反应,所以根据总的反应式可知,铁是负极,氧化镍是正极,答案选A。 本题难度:一般 4、选择题 下列有关钢铁腐蚀与防护的说法正确的是 参考答案:B 本题解析: 本题难度:简单 5、选择题 下列说法正确的是? ( )。 参考答案:B 本题解析:原电池中阴离子向负极移动,阳离子向正极移动,故A错误;电镀中镀件作阴极,接电源负极,故B正确;阳极反应为Cu-2e-===Cu2+,故C错误;Ksp只随温度改变而改变,故D错误。 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《钠及其化合.. | |