1、实验题 某同学想利用原电池反应检测Zn和Cu的金属活动性顺序。请你帮他选择适宜的材料和试剂设计一个原电池,并完成下列实验报告:
实验目的:探究Zn和Cu的金属活动性顺序
(1)电极 材料:正极: ;负极: ;
电解质溶液: 。
(2)写出电极反应式:
正极: ;负极: 。
(3)实验现象:
(4)实验结论:
参考答案:(1)铜片、锌片 ; CuSO 4溶液(可有其他答案)
(2)正极:Cu2+ + 2e- = Cu 负极:Zn
本题解析:
本题难度:一般
2、选择题 一种由甲醇(CH3OH)和氧气以及氢氧化钠做电解质溶液的新型电池,其两极的电极反应式为: 2CH3 OH+16OH-
参考答案:
本题解析:
本题难度:困难
3、选择题 下列反应中,可作为设计化学电源的依据的是( )
A.HCl与NaOH反应
B.SO3与H2O反应
C.H2与O2反应
D.Ba(OH)2?8H2O与NH4Cl反应
参考答案:A.盐酸和氢氧化钠反应属于酸碱中和反应,各元素的化合价不变,属于非氧化还原反应,所以不能设计成化学电源,故A错误;
B.三氧化硫和水反应生成硫酸,该反应属于非氧化还原反应,所以不能设计成化学电源,故B错误;
C.氢气和氧气反应生成水且放出大量热,该反应属于氧化还原反应,所以能设计成化学电源,故C正确;
D.Ba(OH)2?8H2O与NH4Cl反应属于复分解反应,各元素化合价不变,是非氧化还原反应,且该反应吸热,所以不能设计成化学电源,故D错误;
故选C.
本题解析:
本题难度:简单
4、填空题 阅读下表中部分短周期主族元素的相关信息:

请回答:
(1)元素T与X按原子个数比1:1形成的化合物B所含的化学键有____________ (填化学键名称)。已知在通常条件下,39g B与足量CO2反应放出Q kJ的热量,写出该反应的热化学方程式 ____________。
(2)写出Y元素最高价氧化物对应水化物的电离方程式:__________________ 。将Y与Z形成的化合物的水溶液,逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴加边振荡),写出此过程中发生反应的离子方程式______________ 、______________ 。
(3)已知1mol化合物A与Na2SO3在溶液中发生反应时,转移2 mol电子,写出该反应的离子方程式________________ 。
(4)在一定条件下,X、Y两种单质以及有孔惰性电极在化合物TZ的水溶液中可形成原电池,为新型海水航标灯提供能源,写出该原电池正极的电极反应式____________________ 。
参考答案:(1)离子键、非极性共价键?;
2Na2O2(s)+ 2CO2(g) = 2Na2CO3(s)+ O2(g);△H=-4Q kJ/mol?
(2)H++AlO2-+H2O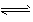 Al(OH)3
Al(OH)3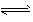 Al3++3OH-? ?;Al3++4OH-= AlO2-+2H2O ;
Al3++3OH-? ?;Al3++4OH-= AlO2-+2H2O ;
Al3+ + 3AlO2-+ 6H2O= 4Al(OH)3↓?
(3)SO32- + ClO- = SO42- + Cl-?
(4)O2 + 4e- + 2H2O = 4OH-
本题解析:
本题难度:一般
5、判断题 (10分)银器皿日久表面逐渐变黑色,这是由于生成硫化银,有人设计用原电池原理进行“抛?光” ,?其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银恢复光泽,且不会损失,试回答:
(1)食盐的作用是?。
(2)在此原电池反应中,负极发生的电极反应为?,正极发生的电极反应为?。
(3)反应过程中产生臭鸡蛋气味的气体,溶液中发生的反应为?,原电池总反应方程式为?。
(4)实际操作中,配制食盐水时,通常还加入一定量的小苏打,其主要作用是?,这一反应的化学方程式是?。
参考答案:(1)作电解质起导电作用
(2)2Al-6e-══2Al3+
3Ag2S+6e-══6Ag+3S2-
(3)2Al3++3S2-+6H2O══2Al(OH)3↓+3H2S↑
2Al+2Ag2S+6H2O══6Ag+2Al(OH)3↓+3H2S↑
(4)除去生成的H2S,防止污染空气
H2S+NaHCO3══NaHS+H2O+CO2↑。
本题解析:(1)形成原电池需要电解质导电,因此NaCl是作电解质起导电作用。
(2)根据题给信息“黑色褪去而银不会损失”,必须发生Ag2S Ag变化。
Ag变化。
铝比银活泼,为负极,失电子变成Al3+,反应为:Al-3e-══Al3+。Ag2S变为Ag和S2-,得电子,是原电池的正极,反应为:Ag2S+2e-══2Ag+S2-。
(3)溶液中
2Al3++3S2-+6H2O══2Al(OH)3↓+3H2S↑。
因此,总反应为:2Al+3Ag2S+6H2O══6Ag+2Al(OH)3↓+3H2S↑。
(4)硫化氢有毒,需除去。因此,NaHCO3的作用是除去生成的H2S,防止污染空气,反应为:
H2S+NaHCO3══NaHS+H2O+CO2↑。
本题难度:简单