1、选择题 下列每组的三种物质中,两边的固体用导线连接后插入中间的液体中,其中能组成原电池装置的是( )
A.Zn|CuCl2溶液|Cu
B.Cu|酒精|Ag
C.石墨|CuSO4溶液|石墨
D.Fe|H2SO4(稀)|Fe
参考答案:A、该装置符合原电池的构成条件,所以能构成原电池,故A正确;
B、酒精是非电解质,酒精和较活泼的金属铜不能自发的发生氧化还原反应,故B错误;
C、两电极材料相同,所以不能构成原电池,故C错误;
D、两电极材料相同,所以不能构成原电池,故D错误;
故选A.
本题解析:
本题难度:简单
2、填空题 (每空1分,共8分)
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+ Fe2++H2↑。
Fe2++H2↑。
(2)实验用品:电极( 、 )、稀硫酸、 (填写所缺的实验用品)、耳机(或者电流计)。
(3)实验装置:
(4)原电池设计及注意的问题。
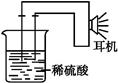
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓”声音。其原因是:在原电池中,由化学能转化为 。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的 极,电极反应是 ;另一极应该接电流计的 极,电极发生了 反应(“氧化”或“还原”)。
参考答案:(2) 铁钉或铁条 铜钉(其他的惰性电极如铅笔芯、石墨等) 烧杯、导线、
(4) ①电能;②负; Fe-2e-==Fe2+ ;正 ;还原。
本题解析:(2)实验用品:电极铁钉或铁条、铜钉(其他的惰性电极如铅笔芯、石墨等)、稀硫酸、烧杯、导线、耳机(或者电流计)。(4) ①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓”声音。其原因是:构成了原电池。在原电池中,由化学能转化为电能;②如果将装置中的耳机改为电流计,则铁钉应该接电流计的负极,电极反应是Fe-2e-==Fe2+;另一极应该接电流计的正极;在正极电极发生了还原反应。
考点:考查原电池的构成、材料的选择、能量的转化、电极式的书写及电极反应的判断的知识。
本题难度:一般
3、选择题 铜片和锌片用导线连接后插入稀硫酸中,锌片是?
[? ]
A.阴极
B.正极
C.阳极
D.负极
参考答案:D
本题解析:
本题难度:简单
4、填空题 如图所示装置中,金属镁、铝和电流表通过导线相连:
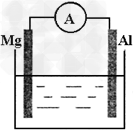
(1)若烧杯中溶液为稀硫酸,则观察到的现象为? 。 两极的电极反应式为:负极?; 正极? 。
(2)该反应过程中,反应物总能量? 生成物总能量(选填“>”“=“<”)。
参考答案:(1)铝棒上产生气泡;负极:Mg-2e-=Mg2+;正极:2H++2e-=H2↑
(2)>
本题解析:
本题难度:一般
5、填空题 (7分)如下图所示,烧杯中都盛有稀硫酸。?
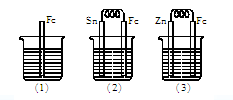
(1)中反应的离子方程式为?。(2分)?
(2)中的电极反应:Fe:?,?Sn:?。?
(3)中被腐蚀的金属是?,其电极反应式为?。?
比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是?。
参考答案:(共7分)(1)Fe+2H+==Fe2++H2↑(2分)
(2)Fe-2e-==Fe2+(1分),? 2H++2e-==H2↑(1分)
(3)Zn(1分), Zn-2e-==Zn2+(1分),(2)>(1)>(3)(1分)
本题解析:(1)装置(1)铁中间和稀硫酸反应置换反应,方程式为Fe+2H+==Fe2++H2↑。
(2)装置(2)中铁比锡活泼,所以铁是负极,锡是正极,电极反应式分别是Fe-2e-==Fe2+、2H++2e-==H2↑。
(3)装置(3)中锌比铁活泼,所以锌是负极,铁是正极,因此倍腐蚀的是锌,方程式为Zn-2e-==Zn2+。根据以上分析可知,(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是(2)>(1)>(3)。
本题难度:一般