1、选择题 下列各表述与示意图一致的是
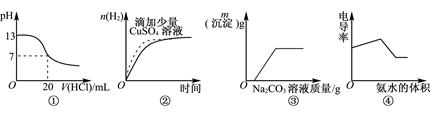
A.图①表示25℃时,0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液
B.图②表示常温下,等量锌粉与足量的等体积等浓度的盐酸反应
C.图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液
D.图④表示向盐酸和醋酸混合溶液中滴入氨水
参考答案:C
本题解析:0.1mol?L-1NaOH溶液的pH为13,用0.1mol?L-1盐酸滴定恰好中和时pH为7,因浓度相同,则体积相同,但酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故A错误;图②中锌与硫酸铜反应置换出铜,从而构成铜锌原电池,加快反应速率,但由于消耗了锌生成的氢气减少,B不正确;向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液,碳酸钠首先与盐酸反应,当盐酸被完全消耗后,碳酸钠才能和氯化钙反应生成碳酸钙白色沉淀,C正确;向盐酸和醋酸混合溶液中滴入氨水,生成氯化铵和醋酸铵,溶液的导电性应该是增强的,D不正确,答案选C。
点评:本题结合图象考查了中和滴定、外界条件对反应速率的影响、离子反应以及溶液导电性,属于综合性试题的考查,侧重对学生解题能力的培养,旨在培养学生分析、归纳、总结问题的能力,答题时要做到善于抓规律,有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力和抽象思维能力。
本题难度:简单
2、选择题 下图是化学实验常用装置之一,若气体从右管进入,可用来收集的气体是
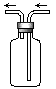
[? ]
A.NO?
B.NO2?
C.CO?
D.SO2
参考答案:BD
本题解析:
本题难度:简单
3、实验题 请回答下列实验室中制取气体的有关问题。
( 1)下图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。
1)下图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。
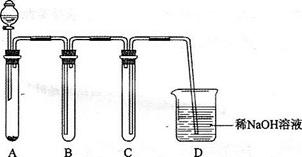
装置B、C、D的作用分别是:
B________________________________________;
C________________________________________;
D________________________________________.
(2)在实验室欲制取适量N0气体。
①下图中最适合完成该实验的简易装置是________(填序号);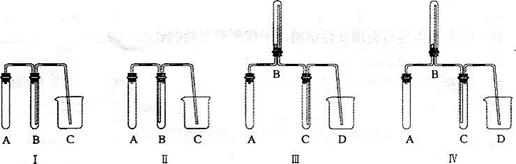
②根据所选的装置完成下表(不需要的可不填):
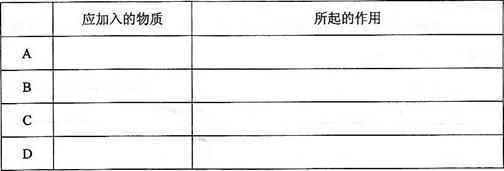
③简单描述应观察到的实验现象_______________________________________。
参考答案:

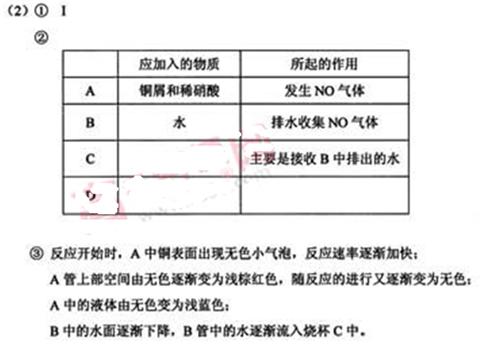
本题解析:略
本题难度:一般
4、实验题 K3[Fe(C2O4)3]·3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应的化学方程式为:Fe+H2SO4 FeSO4+H2↑
FeSO4+H2↑
FeSO4+H2C2O4+2H2O FeC2O4·2H2O↓+H2SO4
FeC2O4·2H2O↓+H2SO4
2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4 2K3[Fe(C2O4)3]+6H2O
2K3[Fe(C2O4)3]+6H2O
2Mn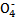 +5C2
+5C2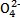 +16H+
+16H+ 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
回答下列问题:
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是 。?

(2)在将Fe2+氧化的过程中,需控制溶液温度不高于40 ℃,理由是 ;得到K3[Fe(C2O4)3]溶液后,加入乙醇的理由是 。?
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤ (叙述此步操作),⑥计算。步骤③若未在干燥器中进行,测得的晶体中所含结晶水含量 (填“偏高”“偏低”或“无影响”);步骤⑤的目的是 。?
(4)晶体中C2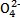 含量的测定可用酸性KMnO4标准溶液滴定。称取三草酸合铁(Ⅲ)酸钾晶体m g溶于水配成250 mL溶液,取出20.00 mL放入锥形瓶中,用0.010 0 mol·L-1酸化的高锰酸钾溶液进行滴定。
含量的测定可用酸性KMnO4标准溶液滴定。称取三草酸合铁(Ⅲ)酸钾晶体m g溶于水配成250 mL溶液,取出20.00 mL放入锥形瓶中,用0.010 0 mol·L-1酸化的高锰酸钾溶液进行滴定。
①下列操作及说法正确的是 。?
A.滴定管用蒸馏水洗涤后,即可装入标准溶液
B.装入标准溶液后,把滴定管夹在滴定管夹上,轻轻转动活塞,放出少量标准液,使尖嘴充满液体
C.接近终点时,需用蒸馏水冲洗瓶壁和滴定管尖端悬挂的液滴
②有同学认为该滴定过程不需要指示剂,那么滴定终点的现象为 ,若达到滴定终点消耗高锰酸钾溶液V mL,那么晶体中所含C2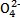 的质量分数为 (用含V、m的式子表示)。?
的质量分数为 (用含V、m的式子表示)。?
参考答案:(1)A (2)防止H2O2分解 三草酸合铁(Ⅲ)酸钾在乙醇中溶解度小 (3)重复②~④步操作至恒重 偏低 检验晶体中的结晶水是否已全部失去
(4)①B ②当滴入最后一滴KMnO4溶液,锥形瓶中溶液恰好由无色变为浅红色,且半分钟不褪色 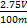
本题解析:(2)注意信息第3个方程式是氧化Fe2+,结合H2O2的性质即可解答;(3)步骤③若未在干燥器中进行,在冷却过程中会吸收水,测得的结晶水含量偏低;(4)n(Mn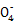 )="V" mL×10-3 L·mL-1×0.010 0 mol·L-1,n(C2
)="V" mL×10-3 L·mL-1×0.010 0 mol·L-1,n(C2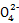 )=n(Mn
)=n(Mn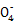 )×
)×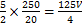 ×10-5 mol,m(C2
×10-5 mol,m(C2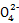 )=
)=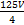 ×10-5 mol×88 g·mol-1=2.75V×10-2 g
×10-5 mol×88 g·mol-1=2.75V×10-2 g
本题难度:一般
5、选择题 下列除去杂质的方法,正确的是( )
A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
参考答案:A、氧气不与CuO反应,不能除去N2中的少量O2,故A错误;
B、CO2与Na2CO3反应生成NaHCO3,除杂时能影响被提纯物质,故B错误;
C、FeCl3与Fe反应生成FeCl2,能将杂质除去,并没有引入新的杂质,故C正确;
D、加入NaOH溶液引入新的杂质,而除杂时不能引入新的杂质,故D错误.
故选C.
本题解析:
本题难度:简单