|
高中化学知识点归纳《气体的净化、干燥、吸收与收集》练习题(八)
2019-07-03 23:16:54
【 大 中 小】
|
1、填空题 (12分)自洁面料就是在普通的面料纤维中加入一层薄薄的纳米二氧化钛。含有Fe2O3的钛铁矿(主要成分为FeTiO3,Ti的最高价为 +4)制取纳米级TiO2的流程如下: +4)制取纳米级TiO2的流程如下:
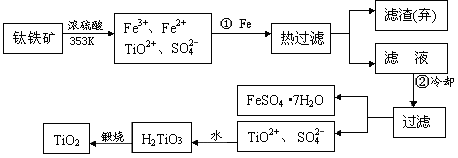
(1)步骤①发生的主要反应是_____?_____?_______(用离子方程式表示)
(2)上述制备二氧化钛的过程中,可以利用的副产物是______________;考虑成本和废物综合利用因素,废液中应加入___________________处理。
(3)由金红石制备单质钛,涉及到的步骤为:
TiO2 TiCl4 TiCl4 Ti? Ti?
已知:①C(s)+O2(g)=CO2(g)?△H=?-393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)?△H=?-566.0kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)?△H=?+141.0kJ·mol-1
则TiO2(s)+ 2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=____________ kJ·mol-1
反应TiCl4+2Mg =?2MgCl2+Ti 在氩气氛中进行的理由是________________________。
(4)TiO2是白色粉末,不溶于水,也不溶于酸,但能溶于氢氟酸和热的浓硫酸中。请写出TiO2与硫酸反应的方程式?
参考答案:(1)2Fe3+ + Fe=3 Fe2+; Fe2+;
(2)FeSO4·7H2O(或绿矾);;石灰(或碳酸钙、废碱)
(3)-80.0;防止高温下镁和钛与空气中氧气(或二氧化碳、或氮气)作用
(4)TiO2 +2H2SO4 Ti(SO4)2 + 2H2O(或TiO2 +H2SO4==TiOSO4 + H2O) Ti(SO4)2 + 2H2O(或TiO2 +H2SO4==TiOSO4 + H2O)
本题解析:略
本题难度:一般
2、实验题 (13分)Ⅰ下列实验操作、现象、结论、说法不正确的是_______________(填序号)
①.苯酚沾在手上立即用酒精洗涤
②.除去淀粉中的少量氯化钠,可以加蒸馏水,用渗析的方法
③.向蛋白质溶液中加入CuSO4盐溶液会使蛋白质发生盐析
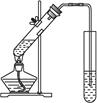
④.制取乙酸乙酯用如右图所示的实验装置
⑤.区别植物油和直馏汽油的正确方法是将它们分别滴入溴水当中,稍加振荡,
观察溴水的颜色是否褪去
⑥.在溴乙烷中加入NaOH水溶液并加热,水层中加入足量HNO3酸化,再滴入AgNO3溶液以检验其是否发生水解
⑦.皂化反应完成后加入食盐可以使高级脂肪酸钠从混合物中析出,这一过程叫盐析
⑧.在蔗糖溶液中滴加几滴稀硫酸,微热,加入新制Cu(OH)2悬浊液煮沸,通过观察有无砖红色沉淀生成来检验蔗糖水解产物是否含有葡萄糖
Ⅱ 实验室需要0.5 mol/L硫酸溶液480mL。回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是_____________(填序号),配制上述溶液还需用到的玻璃仪器是________________(填仪器名称)。

(2)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算结果保留一位小数)。
(3)配制时,该同学的操作顺序如下,请将操作步骤C补充完整。
A.用量筒准确量取所需的浓硫酸,沿玻璃棒倒入盛有适量水的烧杯中。并用玻璃棒不断搅拌至冷却
B.将烧杯中的硫酸沿玻璃棒注入所选的容量瓶中①
C._______________________________________________________________________
D.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2 cm 处
| E.改用胶头滴管滴加,直至凹液面刚好与刻度线相切
F.将容量瓶盖紧,振荡,摇匀
(4)若实验遇到下列情况,会导致硫酸溶液的物质的量浓度偏低的是__________(填序号)
①用以稀释硫酸的烧杯未洗涤?
②量取浓硫酸的量筒未洗涤
③摇匀后发现液面低于刻度线再加水?
④容量瓶中原有少量蒸馏水
⑤定容时观察液面俯视
参考答案:Ⅰ③④⑧?(3分)见错无分Ⅱ(1)A、E(2分)? 500mL容量瓶(2分)(掉容积扣1分)? (2)13.6 (2分)
(3)洗涤烧杯和玻璃棒2~3 次,并将洗涤液也转移到容量瓶中(2分)? (4) ①③(2分)见错无分
本题解析:Ⅰ向蛋白质溶液中加入CuSO4盐溶液会使蛋白质变性,制取乙酸乙酯用如右图所示的实验装置
导管不可以伸入水中。在蔗糖溶液中滴加几滴稀硫酸,微热,先加碱中和再加入新制Cu(OH)2悬浊沸,通过观察有无砖红色沉淀生成来检验蔗糖水解产物是否含有葡萄糖
Ⅱ计算、称量、溶解、转移、洗涤、定容、摇匀。洗涤烧杯和玻璃棒2~3 次,并将洗涤液也转移到容量瓶中。量筒也无需洗涤,都在误差范围内。稀硫酸要全部转移过去,摇匀后再加水溶液被稀释,浓度变小。容量瓶有水不要紧,本来就要加水。高偏高,低偏低。①③偏低,⑤偏高。
本题难度:一般
3、实验题 (12分)下图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹。(已知:氯气在饱和氯化钠溶液中的溶解度较小。)
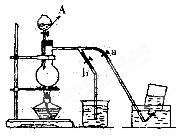
(1)仪器A的名称是?;
烧杯中盛放的是?;
烧瓶中发生的反应化学方程式为?;
(2)在收集氯气时,应? ?。(填:如何操作a、b止水夹,下同), ?。(填:如何操作a、b止水夹,下同),
当氯气收集完毕时应?。
(3)若制得标准状况下的Cl2为0.672L,则被氧化的HCl的物质的量是?
参考答案:

本题解析:略
本题难度:一般
4、实验题 (1)题每空1分,(1)题3分,其余各2分,共15分)
某校化学课外活动小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验。实验室提供如下药品:①2%NaOH溶液②稀HCl③稀H2SO4④饱和KHCO3溶液⑤浓H2SO4⑥CaCO3固体⑦K2CO3粉末⑧纯水。提供如下仪器装置:

请根据题目要求回答下列问题:
(l)请按下表要求,填写选择的装置和药品
?分项
内容
| CO2发生装置(X)
随开随用,随关随停
| 除杂洗气装置(Y)
| 制备产品装置(Z)
| 选择的装置(填序号)
| ?
| ?
| C
| 选择的药品(填序号)
| ?
| ?
| ①
|
(2)如何检验所选择的 发生装置(X)的气密性,请写出主要操作过程: 发生装置(X)的气密性,请写出主要操作过程:
_____________________________________________________________________________
__________________________________________________________________________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为________________,Y装置中除去的杂质为_____________,
(4)常温下,向Z装置的NaOH溶液中通入过量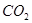 气体,其原因是_________________;通入过量 气体,其原因是_________________;通入过量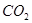 后,Z装置内的溶液中离子浓度大小顺序为:_______________________?。 后,Z装置内的溶液中离子浓度大小顺序为:_______________________?。
参考答案:((1)题每空1分,(1)题3分,其余各2分,共15分)
(1)
选择的装置(填序号)
f
b
?
选择的药品(填序号)
②⑥
④
?
(2)方案1:塞紧单孔塞,(1分)关闭开关,(1分)将烧杯中加入一定量水使干燥管下端管口浸没在水中(1分),如果干燥管内外液面有一定高度差,说明装置的气密性良好(1分)。
方案2:塞紧单孔塞,关闭开关,将烧杯中加入一定量水使干燥管下端管口浸没在水中,如果用手捂住干燥管,管口处出现少量气泡,松手后,干燥管下端管口处出现一段水柱,说明装置的气密性良好(其他方案合理均给分)。 (4分)
(3) (或氯化氢) (或氯化氢)
(4)使溶液中的NaOH完全转化为 ? ?
 ? ?

  
本题解析:(1)要满足随开随用,随关随停免责应该选择f装置,试剂应该是块状的大理石和盐酸。生成的CO2中混有氯化氢,应该用饱和的碳酸氢钾溶液除去氯化氢,装置选择b即可。
(2)考查装置气密性检验的方法。
(3)碳酸钙和盐酸反应生成氯化钙、CO2和水,方程式为 。 。
(4)如果CO2不足,则溶液中会有碳酸钠,所以过量的CO2能使溶液中的NaOH完全转化为 。碳酸氢钠的水解程度电离大于电离程度,溶液显碱性,所以离子浓度大小顺序是 。碳酸氢钠的水解程度电离大于电离程度,溶液显碱性,所以离子浓度大小顺序是 。 。
本题难度:一般
5、简答题
工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为___________;
②硫酸钠和焦炭、石灰石反应的化学方程式为_________(已知产物之一为CaS);
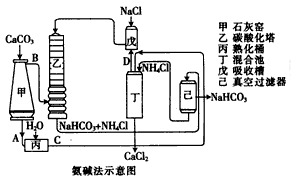
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
?
| ?
| ?
| 
|
①图中的中间产物C是_______,D_______。(写化学式);
②装置乙中发生反应的化学方程式为_______;
(3)联合制碱法对氨碱法的改进,其优点是______________;
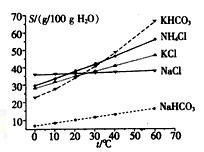
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?__________。
参考答案:(1)①2NaCl+H2SO4(浓) 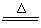 Na2SO4+2HCl↑ Na2SO4+2HCl↑
②Na2SO4+4C+CaCO3 CaS+Na2CO3+4CO或 CaS+Na2CO3+4CO或
Na2SO4+2C+CaCO3 CaS+Na2CO3+2CO2 CaS+Na2CO3+2CO2
(2)①Ca(OH)2? NH3
②NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl
(3)能提高原料的利用率,减少废渣(CaCl2)的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2,除了 CaCO3制 CO2这一工序。
(4)不可行.因为KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,KHCO3的溶解度大于NH4Cl,降温结晶时会析出较多的KCl。
本题解析:(1)由题目信息可知,① 食盐与浓硫酸加热生成硫酸钠和HCl,不加热生成硫酸氢钠和来源:91考试 网HCl,2NaCl+H2SO4(浓)  Na2SO4+2HCl↑②硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,还原C的氧化物CO或CO2生成, Na2SO4+2HCl↑②硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,还原C的氧化物CO或CO2生成,
故反应方程式为:Na2SO4+4C+CaCO3 CaS+Na2CO3+4CO CaS+Na2CO3+4CO
或Na2SO4+2C+CaCO3 CaS+Na2CO3+2CO2 CaS+Na2CO3+2CO2
(2)①碳酸钙加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙,故C为Ca(OH)2;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙,故D为NH3。
②、氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl,反应方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl。
(3)能提高原料的利用率,减少废渣(CaCl2)的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2,革除了 CaCO3制 CO2这一工序。
(4)不可行.因为KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,KHCO3的溶解度大于NH4Cl,降温结晶时会析出较多的KCl。
不可行.因为KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,KHCO3的溶解度大于NH4Cl,降温结晶时会析出较多的KCl
本题难度:一般
| 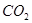 发生装置(X)的气密性,请写出主要操作过程:
发生装置(X)的气密性,请写出主要操作过程: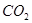 气体,其原因是_________________;通入过量
气体,其原因是_________________;通入过量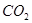 后,Z装置内的溶液中离子浓度大小顺序为:_______________________?。
后,Z装置内的溶液中离子浓度大小顺序为:_______________________?。