1、选择题 实验室中制取的下列气体中,不能用排空气法收集的是?(?)
A.NO2
B.NH3
C.HCl
D.NO
参考答案:D
本题解析:NO具有被氧气氧化生成NO2,所以NO不能用排空气法收集,其余都是可以的,答案选D。
本题难度:一般
2、选择题 图19-1装置可用于( )
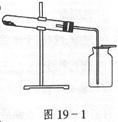
A.加热无水醋酸钠和碱石灰的混合物,制取甲烷。
B.加热氯酸钾和少量二氧化锰的混合物,制取氧气。
C.加热二氧化锰和浓盐酸的混合物,制取氯气。
D.加热氯化铵和消石灰的混合物,制取氨气。
参考答案:B
本题解析:
该装置适宜于固体与固体且需加热,密度比空气大的气体制备。
本题难度:一般
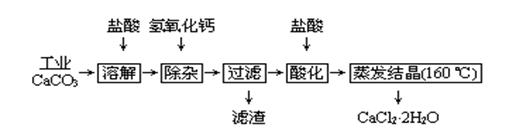
3、实验题 医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙工艺流程为:
已知:查阅资料得知氢氧化物沉淀时的pH为:
氢氧化物
| Fe(OH)3
| Al(OH)3
|
开始沉淀时的pH
| 2.3
| 4.0
| 开始溶解:7.8
|
完全沉淀时的pH
| 3.7
| 5.2
| 完全溶解:10.8
|
?
(1)CaCO3与盐酸反应的离子方程式?。
(2)除杂操作是加入氢氧化钙,调节溶液的pH为?,目的是除去溶液中少量的Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是?
?。
(3)过滤时需用的玻璃仪器有?。滤渣主要成分的化学式?。
(4)酸化时加盐酸的目的为:①?,②防止Ca2+ 在蒸发时发生水解。
(5)为什么蒸发结晶要保持在160℃:?。
(6)测定晶体样品的纯度:若用一定浓度的AgNO3溶液滴定一定质量的晶体样品,所测样品中CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为?。
参考答案:(16分,每空2分)
(1)CaCO3+2H+=Ca2++CO2↑+H2O
(2)5.2~7.8(或之间的任意值、5.2≤pH<7.8)?静置,取少量上层清液于小试管中,滴加KSCN溶液,若不显红色,则Fe(OH)3沉淀完全;反之,则Fe(OH)3沉淀不完全
(3) 烧杯、玻璃棒、普通漏斗? Fe(OH)3、Al(OH)3
(4)除去过量的氢氧化钙(或防止氢氧化钙吸收空气中的二氧化碳,防止钙离子水解等,合理则给分)
(5)温度太高CaCl2 ·2H2O会失水
(6) Na+没除去析出NaCl,导致测定结果偏高(或少量CaCl2 ·2H2O失水)
本题解析:(1)盐酸是强酸,酸性比碳酸强,则难溶于水的碳酸钙易溶于盐酸,生成可溶性的氯化钙、二氧化碳气体和水,将易溶且易电离的化合物改写成离子形式,其余物质都保留化学式,删去实际上未反应的离子,则该反应为CaCO3+2H+=Ca2++CO2↑+H2O;(2)根据表中氢氧化物完全沉淀时的pH可知,除去溶液中少量铁离子和铝离子应使溶液pH介于5.2~7.8之间或者5.2≤pH<7.8,低于3.7时铁离子不能完全变为氢氧化铁沉淀,低于5.2时铝离子不能完全变为氢氧化铝沉淀,高于7.8时,氢氧化铝开始变为偏铝酸根离子,溶液又引入新的杂质;检验氢氧化铁是否沉淀的方法就是检验溶液中是否存在铁离子,由于铁离子遇KSCN溶液变红的特征反应,通常设计的实验方案为:静置,取少量上层清液于小试管中,滴加KSCN溶液,若不显红色,则Fe(OH)3沉淀完全,反之,则Fe(OH)3沉淀不完全;(3)过滤属于化学实验基本操作,也是混合物分离与提纯的常用方法,主要使用烧杯、玻璃棒、普通漏斗等仪器;当溶液pH介于5.2~7.8之间时,铁离子、铝离子完全变为氢氧化铁沉淀、氢氧化铝沉淀,则过滤所得滤渣的成分为Fe(OH)3、Al(OH)3;(4)氢氧化钙是除杂试剂,除杂试剂一定过量,氢氧化钙是强碱,由于目标产物是氯化钙,则酸化时加入盐酸的目的是除去过量的氢氧化钙,将其转化为氯化钙,防止氢氧化钙吸收空气中的二氧化碳,且过量的盐酸受热易挥发逸出(逸出的氯化氢气体可循环利用),不能加硝酸或硫酸酸化,因为它们除去旧杂质时会引入硝酸根离子或硫酸根离子等新杂质;(5)结晶水化合物受热可能失去结晶水,蒸发结晶要控制温度在160℃的原因是,温度太高,二水合氯化钙会失去结晶水;(6)滴定原理为:Ag++Cl-=AgCl↓,若氯离子的物质的量偏大,则测定结果偏高;酸化后所得溶液主要含有氯化钙、氯化钠、氯化氢,蒸发结晶时逸出氯化氢,但是没有除去钠离子,则所得晶体是二水合氯化钙和氯化钠的混合物,氯元素的质量分数:CaCl2>NaCl> CaCl2?H2O >CaCl2?2H2O,因此晶体样品中含有NaCl或二水合氯化钙失去全部或部分结晶水得到的CaCl2或CaCl2?H2O,都能导致所含氯元素的质量分数偏高,则所测样品二水合氯化钙的质量分数偏高。
本题难度:困难
4、选择题 括号内物质为杂质,下列除去杂质的做法不正确的是
A.乙酸乙酯(乙酸和乙醇):用饱和Na2CO3溶液洗涤后分液
B.乙烷(乙烯):用浓溴水洗气
C.乙醇(乙酸):用NaOH溶液中和后分液
D.乙醇(水):用生石灰吸水后蒸馏
参考答案:C
本题解析:略
本题难度:简单
5、选择题 在CO2中混有少量的O2、H2S、水蒸气和HCl,今用下列四种试剂①浓硫酸;②饱和CuSO4溶液;③饱和NaHCO3溶液;④红热的铜丝,除去上述杂质而得到纯净的CO2气体,此混合气体通过四种试剂的顺序最好是( )
A.②①③④
B.③④①②
C.④①③②
D.②③①④
参考答案:A、通过硫酸铜溶液除去硫化氢和氯化氢,通过浓硫酸除去水蒸气,通过饱和碳酸氢钠溶液会带出水蒸气,影响通过灼热铜网的温度,故A错误;
B、通过饱和碳酸氢钠会带出水蒸气,影响影响通过灼热铜网的温度,通过饱和硫酸铜还会带出水蒸气.故B错误;
C、通过灼热的铜将氧气除去,水蒸气影响通过灼热铜网的温度,通过饱和碳酸氢钠和饱和硫酸铜会带出水蒸气,故C错误;
D、用饱和硫酸铜吸收硫化氢气体,用饱和碳酸氢钠溶液吸收氯化氢,干燥后用红热的铜网除去氧气.关于除杂和干燥,其一般规律是溶液除杂在前,干燥在后,需加热除去的杂质放到最后,其原因是气体通过溶液将带出水蒸气,干燥剂可除去这些水蒸气,故D正确.
故选D.
本题解析:
本题难度:一般