1、填空题 (1)X原子在第二电子层上只有一个空轨道,则X是______;其轨道表示式为______;R原子的3p轨道上只有一个未成对电子,则R原子可能是______、______;Y原子的核电荷数为29,其电子排布式是______,其在元素周期表中的位置是______,是属于______区的元素.
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:______、______、______.
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.
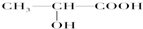
______
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)______.
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4______H2SO3;?H3PO4______H3PO3.
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为______杂化,分子的立体构型为______.
BF3分子中,中心原子的杂化方式为______杂化,分子的立体构型为______.
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于______.
参考答案:(1)X原子在第二电子层上只有一个空轨道,则价层电子排布式为2s22p2,则X是C元素,轨道表示式为
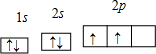
;
R原子的3p轨道上只有一个未成对电子,则价层电子排布式为3s23p1或3s23p5,则R为Al元素或Cl元素;
Y原子的核电荷数为29,为Cu元素,核外电子排布式为1s22s22p63s23p63d104s1,处于周期表中第四周期第ⅠB族,
故答案为:C;

;Al;Cl;1s22s22p63s23p63d104s1;第四周期第ⅠB族;ds;
(2)配合物K3[Co(CN)6]中的中心离子为Co3+、配位体是CN-、配位数为6,
故答案为:Co3+、CN-,6;
(3)连接4个不同的原子团或原子的碳原子是手性碳原子,图
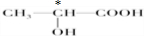
中标“*”为手性碳原子,
故答案为:
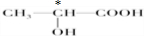
;
(4)①CO2中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
②NH3中C元素化合价为-3,N原子最外层5个电子未全部成键,为极性分子;
③CCl4中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
④BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子;
⑤H2O中O元素化合价为-2,O原子最外层6个电子未全部成键,为极性分子;
⑥SO2中S元素化合价为+4,S原子最外层6个电子未全部成键,为极性分子;
⑦SO3中S元素化合价为+6,S原子最外层6个电子全部成键,为非极性分子;
⑧PCl3中P元素化合价为+3,P原子最外层5个电子未全部成键,为极性分子;
故选①③④⑦;
(5)H2SO4中S元素化合价为+6,H2SO3中S元素化合价为+4,故酸性H2SO4>H2SO3.H3PO4 中P元素化合价为+5,H3PO3中P元素化合价为+3,故酸性H3PO4>H3PO3,
故答案为:>;>;
(6)H2O中心原子O原子成2个σ键、含有2对孤对电子,故杂化轨道数为4,采取sp3杂化,故空间结构为V形,
BF3分子中,中心B原子成3个σ键、没有孤对电子,故杂化轨道数为3,采取sp2杂化,故空间结构为平面正三角形,
故答案为:sp3;V形;sp2;平面正三角形;
(7)水分子之间存在氢键,沸点高于同族其它元素氢化物,故答案为:水分子之间存在氢键.
本题解析:
本题难度:一般
2、选择题 下列说法中正确的是( )
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
参考答案:A.非金属元素呈现的最高化合价等于原子最外层电子数,不超过该元素原子的最外层电子数,故A正确;
B.非金属元素呈现的最低化合价为原子最外层电子数-8,最高化合价等于原子最外层电子数,故B错误;
C.He最外层电子数为2,为非金属元素,故C错误;
D.最外层有5个电子的原子位于周期表第ⅤA族,第ⅤA元素既有金属元素也有非金属元素,故D错误.
故选A.
本题解析:
本题难度:一般
3、填空题 某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是
________________。
参考答案: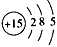
本题解析:
本题难度:一般
4、选择题 下列说法正确的是( )
A.元素周期律是元素原子核外电子排布周期性变化的结果
B.HCl、H2S、PH3、SiH4的热稳定性和还原性均依次增强
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.非金属元素的原子两两结合形成的化合物不一定是共价化合物
参考答案:A
本题解析:
本题难度:简单
5、简答题 U、V、W、X、Y、Z六种原子序数依次增大前20号元素,其中U和X,W和Y分别在同一主族,Y的原子序数是W的原子序数两倍,Z的原子序数是U和X的原子序数之和.根据以上条件回答下列问题:
(1)写出U、V组成的阴离子(U、V都满足8电子稳定结构)和Z的阳离子形成的化合物的电子式:______;
(2)W元素可分别U、Y形成多种常见的阴离子.某溶液是由其中若干种阴离子组成的无机钠盐溶液,为了检验该溶液中的阴离子,分别取两份溶液进行如下实验:
①第一份溶液中加入足量盐酸溶液,只产生无色气体;
②第二份溶液中加入足量的BaCl2溶液,有白色沉淀产生,再加入足量的稀HNO3,白色沉淀质量减少.
由此得出的结论是______.
参考答案:(1)通过以上分析知,U、V、W、X、Y、Z分别是碳元素、氮元素、氧元素、硅元素、硫元素、钙元素,U、V组成的阴离子(U、V都满足8电子稳定结构),所以该阴离子是CN-,Z的阳离子是钙离子,所以氢氰根离子和钙离子形成的离子化合物是氰化钙,电子式为
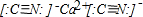
,
故答案为:
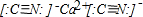
;
(2)W元素可分别U、Y形成多种常见的阴离子,W和U形成的阴离子有碳酸根离子和碳酸氢根离子,W和Y形成的阴离子有亚硫酸根离子和硫酸根离子;
①第一份溶液中加入足量盐酸溶液,只产生无色气体,说明含有弱酸根离子,碳 酸根离子、碳酸氢根离子和亚硫酸根离子都是弱酸根离子,所以能和盐酸反应生成无色气体的离子可能是碳酸根离子、硫酸根离子和亚硫酸根离子;
②第二份溶液中加入足量的BaCl2溶液,有白色沉淀产生,再加入足量的稀HNO3,白色沉淀质量减少,能和氯化钡反应生成沉淀的有碳酸根离子、硫酸根离子和亚硫酸根离子,再加入足量的稀HNO3,白色沉淀质量减少,说明含有弱酸根离子,但亚硫酸根离子能被硝酸氧化生成硫酸根离子,所以该溶液中一定含有碳酸根离子,可能含有亚硫酸根离子和硫酸根离子至少有一种.
故答案为:一定含有碳酸根离子,亚硫酸根离子和硫酸根离子至少有一种.
本题解析:
本题难度:一般